Атеросклероз и дислипидемии. Российские клинические рекомендации 2020
Рекомендации с целью профилактики и лечения Диагностика и коррекция атеросклероза нарушений липидного обмена Российские рекомендации, с целью профилактики и лечения VII пересмотр
Национальное общество по изучению атеросклероза (НОА)
Российское кардиологическое общество (РКО)
Российская диабетическая ассоциация (РДА)
Для цитирования: Атеросклероз и дислипидемии. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VII пересмотр. 2020;1(38):7-42. DOI: 10.34687/2219-8202.JAD.2020.01.0002
Рабочая группа:В. В. Кухарчук, М. В. Ежов, И. В. Сергиенко, Г. Г. Арабидзе, М. Г. Бубнова, Т. В. Балахонова, В. С. Гуревич, М. А. Качковский, Г. А. Коновалов, В. О. Константинов, П. П. Малышев, С. Н. Покровский, А. А. Соколов, А. Б. Сумароков, Н. Б. Горнякова, А. Г. Обрезан, И. И. Шапошник
Diagnostics and correction of lipid metabolism disorders in order to prevent and treat of atherosclerosis Russian recommendations VII revision. Moscow, 2020
Russian National Atherosclerosis Society
Russian Society of Cardiology
Russian Diabetes Association
V.V. Kukharchuk, M.V. Ezhov, I.V. Sergienko, G.G. Arabidze, M.G. Bubnova, T.V. Balakhonova, V. S. Gurevich, M.A. Kachkovsky, G.A. Konovalov, V.O. Konstantinov, P.P. Malyshev, S.N. Pokrovsky, A. A. Sokolov, A. B. Sumarokov, N. B. Gornyakova, A. G. Obrezan, I. I. Shaposhnik
Совет экспертов
- 1. М. Б. Анциферов (Москва)
- 2. А. А. Аншелес (Москва)
- 3. Д. М. Аронов (Москва)
- 4. Н. М. Ахмеджанов (Москва)
- 5. О. Л. Барбараш (Кемерово)
- 6. С. А. Бойцов (Москва)
- 7. М. И. Воевода (Новосибирск)
- 8. Г. Р. Галстян (Москва)
- 9. А. С. Галявич (Казань)
- 10. О. М. Драпкина (Москва)
- 11. Д. В. Дупляков (Самара)
- 12. С. Я. Ерёгин (Ярославль)
- 13. Р. С. Карпов (Томск)
- 14. Ю. А. Карпов (Москва)
- 16. Н. А. Козиолова (Пермь)
- 17. Е. Д. Космачёва (Краснодар)
- 18. Д. В. Небиеридзе (Москва)
- 19. С. В. Недогода (Волгоград)
- 20. В. Э. Олейников (Пенза)
- 21. Ю. И. Рагино (Новосибирск)
- 22. В. В. Скибицкий (Краснодар)
- 23. О. Г. Смоленская (Екатеринбург)
- 24. А. Е. Филиппов (Санкт-Петербург)
- 25. Ю. Ш. Халимов (Санкт-Петербург)
- 26. И. Е. Чазова (Москва)
- 27. М. В. Шестакова (Москва)
- 28. С. С. Якушин (Рязань)
Список сокращений
- АГ – артериальная гипертония
- АД – артериальное давление
- АЛТ – аланинаминотрансфераза
- АпоВ – аполипопротеин В
- АСБ – атеросклеротическая бляшка
- АСТ – аспартатаминотрансфераза
- АССЗ – атеросклеротическое сердечно-сосудистое заболевание
- ВГН – верхняя граница нормы
- ВОЗ – Всемирная организация здравоохранения
- ГЛП – гиперлипидемия
- ГТГ – гипертриглицеридемия
- ГХС – гиперхолестеринемия
- ДВ – (препарат) длительного высвобождения
- ДИ – доверительный интервал
- ДЛП – дислипидемия
- ЖНВЛП – жизненно необходимые важнейшие лекарственные препараты
- ЗОЖ – здоровый образ жизни
- ИБС – ишемическая болезнь сердца
- ИМТ – индекс массы тела
- КАГ – коронароангиография
- КИ – кальциевый индекс
- КТ – компьютерная томография
- КФК – креатинфосфокиназа
- КШ – коронарное шунтирование
- ЛВП – липопротеиды высокой плотности
- ЛНП – липопротеиды низкой плотности
- мпЛНП – мелкие плотные липопротеиды низкой плотности
- неЛВП – липопротеиды невысокой плотности
- Лп(а) – липопротеид (а)
- ЛП-аферез – аферез липопротеидов
- ЛПП – липопротеиды промежуточной плотности
- ЛОНП – липопротеиды очень низкой плотности
- ОКС – острый коронарный синдром
- ОР – относительный риск
- ОХС – общий холестерин
- ПНЖК – полиненасыщенные жирные кислоты
- РКИ – рандомизированные клинические исследования
- РЛНП – рецептор к липопротеидам низкой плотности
- СГХС – семейная гиперхолестеринемия
- СД – сахарный диабет
- СКФ – скорость клубочковой фильтрации
- ССР – сердечно-сосудистый риск
- ССЗ – сердечно-сосудистые заболевания
- ССО – сердечно-сосудистые осложнения
- ТГ – триглицериды
- ТИА – транзиторная ишемическая атака
- ФР – факторы риска
- ХБП – хроническая болезнь почек
- ХМ – хиломикроны
- ХС – холестерин
- ЧКВ – чрескожное коронарное вмешательство
- ESC – Европейское общество кардиологов
- EAS – Европейское общество атеросклероза
- NCEP-ATP III – Национальная программа по снижению ХС в США, III версия
- NHANES – Национальная программа США по наблюдению за здоровьем и характером питания населения
- PCSK9 – пропротеин-конвертаза субтилизин/ кексин типа 9
- SCORE – системная оценка коронарного риска (Systematic Coronary Risk Evaluation)
Коэффициенты переводов липидных показателей
Для перевода ОХС, ХС ЛНП и ХС ЛВП из ммоль/л в мг/дл умножить значение на 38,67.
Для перевода ТГ из ммоль/л в мг/дл умножить значение на 88,7.
Оглавление
- Семейная гипохолестеринемия
- Медикаментозное лечение СГХС у взрослых
- Медикаментозное лечение СГХС у детей
- Аферез липопрагеидов
- Терапия дилипидемии у женщин
- Терапия дилипидемии у пожилых
- Пациенты с острыми коронарным синдромом и кандидаты на чрескожные коронарные вмешательства
- Пациенты с хронической болезнью почек
Введение
Согласно данным Росстата, смертность от заболеваний сердечно-сосудистой системы (ССЗ) в Российской Федерации в 2017 г. составила 587,6 случая на 100 тыс. населения при первичной регистрации 4 млн 706 тыс. пациентов с болезнями системы кровообращения [1,2]. Эти показатели свидетельствуют о необходимости профилактических мер на популяционном и индивидуальном уровне, направленных на устранение или сведение к минимуму частоты ССЗ и связанной с ними потери трудоспособности. Возникновение ССЗ связывают с факторами риска (ФР), среди которых выделяют модифицируемые и немодифицируемые. К немодифицируемым ФР относятся возраст, пол, отягощенная наследственность по ССЗ, к модифицируемым – дислипидемии (ДЛП), артериальная гипертония (АГ), курение, сахарный диабет (СД) 2 типа и компоненты нездорового образа жизни (ожирение, гиподинамия, питание с избыточным потреблением насыщенных жиров и рафинированных углеводов).
Настоящие рекомендации являются обновлением VI пересмотра Российских рекомендаций по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, изданных в 2017 году, и ориентированы на кардиологов и врачей общей практики. В Рекомендациях учтены изменения последней версии Рекомендаций ESC/EAS по коррекции ДЛП и снижению сердечно-сосудистого риска (ССР) в клинической практике [3–5]. Основные новые положения VII пересмотра Рекомендаций следующие:
- Предложен более низкий целевой уровень холестерина (ХС) липопротеидов низкой плотности (ЛНП) для категории очень высокого ССР – 1,4 ммоль/л. Введена категория экстремального риска.
- Дополнены описания категорий высокого и очень высокого риска за счет указания не только степени стеноза, но и тяжести атеросклеротического поражения периферических артерий.
- Обозначена значимость определения уровня липопротеида (а) и проведения инструментальной диагностики субклинического атеросклероза.
- Отмечена значимость для вторичной профилактики атеросклероза нового класса препаратов – ингибиторов пропротеин-конвертазы субтилизин/кексин типа 9 (PCSK9).
- Расширены и обновлены главы, касающиеся гипертриглицеридемии (ГТГ) и ДЛП при СД 2 типа.
В соответствии с существующими требованиями к рекомендациям каждое их положение характеризуется классом и уровнем его доказанности (табл.1, 2).
Классификация дислипидемий
Понятие ДЛП включает широкий спектр нарушений липидного обмена. Это состояния, когда
концентрации липидов и липопротеидов крови выходят за пределы нормы и могут быть как приобретенными (вторичными), так и наследственными (первичными) [3]. ДЛП классифицируют в зависимости от того, уровень каких именно липидов и липопротеидов выходит за пределы нормы. Крайне важно дифференцировать первичные и вторичные ДЛП, так как в этих случаях принципиально отличается тактика лечения. Основными причинами вторичных ДЛП являются СД, гипотиреоз, хроническая болезнь почек (ХБП). В настоящее время ВОЗ принята классификация гиперлипопротеидемий (ГЛП), предложенная
D. Fredrickson (1965), согласно которой выделяют несколько ее фенотипов (табл. 3). Следует подчеркнуть, что классификация не устанавливает диагноз, а лишь фиксирует тип ГЛП вне зависимости от того, является ли она приобретенной или наследственной. Таблица также позволяет определить риск развития атеросклероза в зависимости от типа ГЛП: так, IIа, IIb и III типы являются атерогенными, в то время как I, IV и V типы – «относительно» атерогенными.
Применяя классификацию ГЛП с целью выработки терапевтической стратегии, необходимо учитывать значения других липидных параметров, не включенных в классификацию ВОЗ, в первую очередь уровни ХС ЛВП и липопротеида (а) [Лп(а)].
Таблица 1. Классификация рекомендаций
| Класс I | Рекомендуемое вмешательство и/или терапия несомненно полезны и эффективны | |||||
|---|---|---|---|---|---|---|
| Класс IIa | Рекомендуемое вмешательство скорее всего полезно и эффективно | |||||
| Класс IIb | Рекомендуемое вмешательство не получило убедительных данных своей эффективности и не сопровождается очевидной пользой | |||||
| Класс IIb | Польза, эффективность рекомендуемого вмешательства и/или терапии не подтверждены в исследованиях и даже может принести вред | |||||
Таблица 2. Уровень доказанности в рекомендациях
| Уровень А | Данные получены из нескольких рандомизированных клинических исследований | |||||
|---|---|---|---|---|---|---|
| Уровень В | Данные основываются на результатах одного рандомизированного исследования или нескольких нерандомизированных исследований | |||||
| Уровень С | Рекомендуемые методы основаны на соглашении экспертов, на отдельных клинических наблюдениях, на стандартах оказания медицинской помощи | |||||
Таблица 3. Классификация ГЛП, принятая ВОЗ
| Фенотип | Синоним | Повышение уровня липопротеидов плазмы | Повышение уровня липидов плазмы | Атеро-генность | Частота (%) в структуре ДЛП | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | Гиперхиломикронемия | ХМ | ТГ и ХС | + | < 1 | ||||||||||
| II | a | Гиперхолестеринемия | ЛНП | ХС | +++ | 10 | |||||||||
| b | Комбинированная гиперлипидемия | ЛНП,ЛОНП | ТГ и ХС | +++ | 40 | ||||||||||
| III | Дисбеталипопротеидемия | ЛПП | ТГ и ХС | +++ | < 1 | ||||||||||
| IV | Гипертриглицеридемия | ЛОНП | ТГ | + | 45 | ||||||||||
| V | Смешанная гиперлипидемия | ХМ, ЛОНП | ТГ и ХС | + | 5 | ||||||||||
Примечания: ХМ – хиломикроны; ХС – холестерин; ТГ – триглицериды; ЛНП – липопротеиды низкой плотности; ЛПП – липопротеиды промежуточной плотности; ЛОНП – липопротеиды очень низкой плотности.
Скрининг дислипидемий
Скрининг на ДЛП показан у пациентов с ССЗ, при неблагоприятном семейном анамнезе, а также при некоторых клинических состояниях, ассоциированных с повышенным ССР. У пациентов, страдающих ХБП, повышен риск развития ССЗ, поэтому их также необходимо обследовать для выявления ДЛП. Следует обращать внимание на наличие сухожильных
и кожных ксантом, ксантелазм век или липоидной дуги роговицы у лиц моложе 45 лет. Эти проявления свидетельствуют о выраженном нарушении липидного обмена, и вероятной семейной гиперхолестеринемии (СГХС). Детальное обследование для выявления ДЛП также показано пациентам с заболеваниями периферических артерий. Выявление ФР, включая ДЛП, нужно проводить у мужчин, достигших 40 лет, и женщин, достигших 50 лет или после наступления менопаузы. Однако, при СД, отягощенной наследственности, скрининг следует проводить у мужчин и женщин с 20 лет. Образцы крови для анализа липидов обычно берутся натощак, однако последние исследования говорят о том, что колебания концентрации липидов
плазмы крови, за исключением триглицеридов (ТГ), существенно не зависят от приема пищи и поэтому для скрининга забор крови можно проводить не натощак [6, 7].
Наиболее распространенным способом определения ХС ЛНП в клинических лабораториях является расчетный. В этом случае определяют концентрации ХС и ТГ в сыворотке крови и концентрацию ХС ЛВП в супернатанте после преципитации ЛП, содержащих апоВ (ЛОНП и ЛНП), и вычисляют уровень ХС ЛНП по формуле Фридвальда:
ХС ЛНП (в мг/дл) = общий ХС – ХС ЛВП – ТГ/5
ХС ЛНП (в ммоль/л) = общий ХС – ХС ЛВП – ТГ/2,2
В основе этой формулы лежат два допущения:
1) большая часть ТГ-плазмы находится в липопротеидах очень низкой плотности (ЛОНП) и хиломикронах (ХМ); 2) отношение массы ТГ/ХС в мг в ЛОНП равно 5:1, а в ммолях – 2,2:1.
Формула Фридвальда не применяется при высоких ТГ > 4,5 ммоль/л (> 400 мг/дл). В настоящее время разработаны прямые методы выделения ЛНП [5]. У лиц с концентрацией ТГ > 4,5 ммоль/л, III типом ГЛП и СД 2 типа анализ крови нужно брать натощак [8].
Оценка риска развития сердечно-сосудистых осложнений
Современный алгоритм обследования состоит из следующих основных этапов: выявление основных ФР (табл. 4) и клинических симптомов атеросклероза (данные опроса и осмотра); определение липидного профиля (венозная кровь); оценка ССР по шкале SCORE; исключение/верификация субклинического и клинически значимого атеросклероза (инструментальные методы обследования). Показатели липидного профиля, которые требуется определить для оценки сердечно-сосудистого риска (ССР), представлены в табл. 5.
Таблица 4. Факторы риска развития и прогрессирования атеросклероза
| Факторы риска | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Возраст | Мужчины > 40 лет, женщины > 50 лет или с ранней менопаузой |
I | С | ||||
| Курение | Вне зависимости от количества | I | С | ||||
| Артериальная гипертония | АД ≥ 140/90 мм рт. ст. или постоянный прием гипотензивных препаратов | I | С | ||||
| Сахарный диабет 2 типа | Глюкоза натощак > 6,1 и 7,0 ммоль/л (капиллярная и венозная кровь соответственно) | I | С | ||||
| Раннее начало ИБС у ближайших родственников (отягощенная наследственность) | Инфаркт миокарда или нестабильная стенокардия у мужчин в возрасте < 55 лет, у женщин < 60 лет | I | С | ||||
| Смешанная гиперлипидемия | ХМ, ЛОНП | I | С | ||||
| Семейная гиперлипидемия по данным анамнеза | IIа, IIb | I | С | ||||
| Абдоминальное ожирение | Окружность талии: у мужчин ≥ 94 см, у женщин ≥ 80 см | I | С | ||||
| Хроническое заболевание почек | Снижение скорости клубочковой фильтрации < 60 мл/мин | I | С | ||||
| Ожирение | Повышение ИМТ > 25 кг/м2 | I | С | ||||
Примечания: АД – артериальное давление; ИБС – ишемическая болезнь сердца; ИМТ – индекс массы тела.
Таблица 5. Показатели липидного профиля для оценки сердечно-сосудистого риска
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| ОХС – для оценки риска в системе SCORE | I | С | |||||
| ХС ЛВП – для дополнительной оценки риска | I | С | |||||
| ХС ЛНП – главный показатель оценки риска | I | С | |||||
| ТГ – рекомендован для дополнительной оценки риска | I | С | |||||
| ХС неЛВП – для оценки риска, в частности при высоких ТГ, СД, ожирении, метаболическом синдроме или очень низком ХС ЛНП | I | С | |||||
| АпоВ – для оценки риска, в частности при высоких ТГ, СД, ожирении, метаболическом синдроме или очень низком ХС ЛНП | I | С | |||||
| Лп(а) – следует измерить хотя бы раз в жизни у любого взрослого. При уровне Лп(а) > 180 мг/дл риск эквивалентен гетерозиготной СГХС | IIA | С | |||||
| Лп(а) следует измерять у пациентов с отягощенным семейным анамнезом для рестратификации риска между умеренным и высоким | IIA | С | |||||
Примечания: ОХС – общий холестерин; SCORE – системная оценка коронарного риска (Systematic Coronary Risk Evaluation); ХС ЛВП – липопротеиды высокой плотности; ХС ЛНП – липопротеиды низкой плотности; ТГ – триглицериды; СД – сахарный диабет; ХС неЛВП–липопротеиды невысокой плотности; Лп(а) – липопротеид (а); СГХС – семейная гиперхолестеринемия.
Оценка сердечно-сосудистого риска по шкале SCORE
В европейских странах ССР оценивают по шкале SCORE (Systematic Coronary Risk Evaluation).
Шкала рассчитывает абсолютный риск смерти от ССЗ в процентах в течение ближайших 10 лет. Согласно SCORE выделяют 4 категории риска: очень высокий, высокий, умеренный и низкий.
Есть 2 типа шкалы SCORE: для стран с высоким ССР и для стран с низким ССР. Среди первых
выделяют еще страны, где смертность от ССЗ превышает 350/100 000 населения. К ним относятся Азербайджан, Республика Беларусь, Болгария, Египет, Грузия, Казахстан, Кыргызстан, Северная Македония, Республика Молдова, Российская Федерация, Сирия, Таджикистан, Туркменистан, Украина и Узбекистан.
Показатели, определяемые с помощью системы SCORE, могут отличаться в разных популяциях в зависимости от распространенности ФР и смертности от ССЗ. Откалиброванные версии для конкретной страны могут быть найдены на http://www. heartscore.org. Десятилетний риск оценки смертельных исходов от ССЗ в популяциях с высоким риском основан на следующих ФР: возраст, пол, курение, систолическое АД и общий ХС (ОХС). Чтобы получить значение риска развития ишемической болезни сердца (ИБС) в % по шкале SCORE, нужно полученный показатель фатального исхода умножить на 3 у мужчин и на 4 у женщин. Электронная версия SCORE, HeartScore (http:// www.heartscore.org/en_GB/) была модифицирована для учета ХС ЛВП. [5].
Лица с документированным ССЗ, СД 1 или 2 типа, большим количеством ФР или с ХБП,
как правило, имеют очень высокий или высокий риск ССЗ. Для них оценка риска по шкале SCORE не требуется.
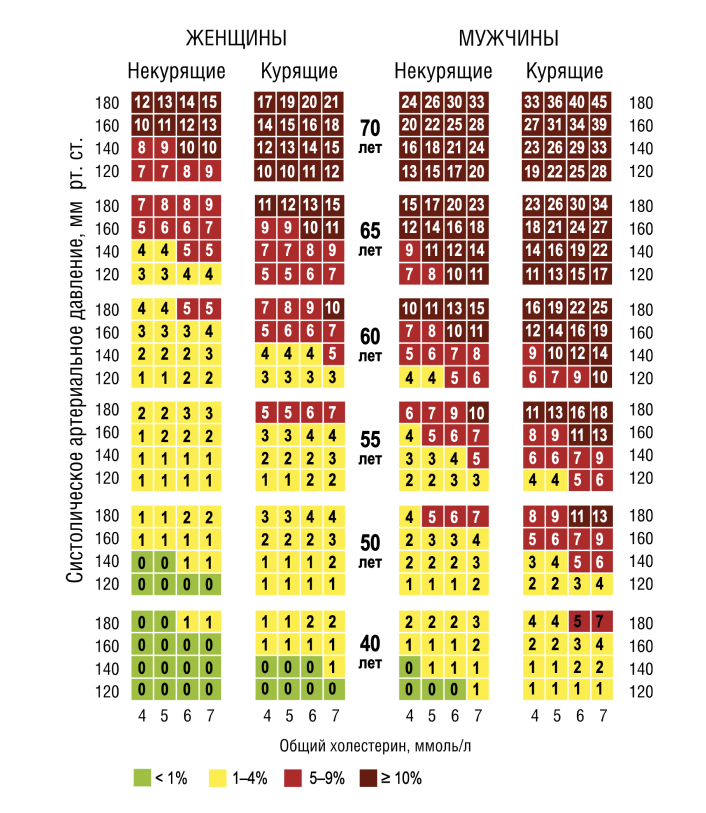
Для оценки риска по шкале SCORE следует выбрать квадрат в зависимости от пола, возраста
и статуса курения пациента. В найденном квадрате следует отыскать ячейку, наиболее соответствующую уровню систолического АД и ОХС данного пациента (рис. 1).
Рис. 1. Шкала SCORE для определения риска развития сердечно-сосудистой смерти в ближайшие 10 лет
Категории сердечно-сосудистого риска
Категории ССР и их критерии представлены в табл. 6.
Таблица 6. Категории сердечно-сосудистого риска [5]
| Очень высокий | Документированное АССЗ клинически или по результатам обследования, включая перенесенный ОКС, стабильную стенокардию, ЧКВ, КШ или другие операции на артериях, инсульт/ТИА, поражения периферических артерий АССЗ по данным инструментальных обследований – значимая АСБ (стеноз > 50%) СД + поражение органов-мишеней, ≥ 3 ФР, а также раннее начало СД 1 типа с длительностью > 20 лет Выраженная ХБП с СКФ < 30 мл/мин/1,73 м2 Оценка по шкале SCORE ≥ 10% СГХС в сочетании с АССЗ или с другими ФР |
||||
|---|---|---|---|---|---|
| Высокий | Один значимо выраженный ФР – ХС > 8 ммоль/л и/или ХС ЛНП > 4,9 ммоль/л и/или АД ≥ 180/110 мм рт. ст. СГХС без других ФР СД без поражения органов-мишеней, СД ≥ 10 лет или с ФР Умеренная ХБП с СКФ 30–59 мл/мин/1,73 м2 Гемодинамически незначимый атеросклероз артерий (стеноз(ы) 25–49%) Оценка по шкале SCORE 5–10% |
||||
| Умеренный | Молодые пациенты (СД 1 типа – моложе 35 лет, СД 2 типа – моложе 50 лет) с длительностью СД < 10 лет без поражения органов-мишеней и ФР Оценка по шкале SCORE 1–5% |
||||
| Низкий | Оценка по шкале SCORE < 1% | ||||
Примечания: АССЗ – атеросклеротическое сердечно-сосудистое заболевание; ОКС – острый коронарный синдром;
ЧКВ – чрескожное коронарное вмешательство; КШ – коронарное шунтирование; ТИА – транзиторная ишемическая
атака; АСБ – атеросклеротическая бляшка; СД – сахарный диабет; ФР – фактор риска; ХБП – хроническая болезнь
почек; СКФ – скорость клубочковой фильтрации; SCORE – системная оценка коронарного риска (Systematic Coronary
Risk Evaluation); СГХС – семейная гиперхолестеринемия; ХС – холестерин; ЛНП – липопротеиды низкой плотности;
АД – артериальное давление.
На основании ряда клинических исследований, описанных ниже, внутри категории очень
высокого риска следует выделить категорию лиц с экстремальным риском. К экстремальному риску следует отнести:
– сочетание клинически значимого АССЗ с СД 2 типа и/или с СГХС;
– сердечно-сосудистые осложнения (ССО) у пациента с АССЗ, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП < 1,4 ммоль/л;
– 2 ССО и более в течение 2 лет, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП < 1,4 ммоль/л.
К АССЗ относятся ИБС, ишемический инсульт или транзиторное нарушение мозгового кровообращения, атеросклероз периферических артерий нижних конечностей и артерий другой локализации. Таким образом, с введением категории экстремального риска классификация категорий риска ССО приобретает следующий вид (табл. 7).
Как видно из таблицы, у пациентов экстремального риска требуется достигать целевого уровня ХС ЛНП как минимум < 1,4 ммоль/л и оптимально – < 1,0 ммоль/л.
Таблица 7. Категории ССР с учетом экстремального риска и целевые уровни ХС ЛНП
| Риск | Определение | Целевой уровень ХС ЛНП (ммоль/л) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Экстремальный | Сочетание АССЗ¹ с СД 2 типа и/или СГХС или два сердечно-сосудистых осложнения в течение 2 лет² у пациента с АССЗ, несмотря на оптимальную гиполипидемическую терапию³ и/или достигнутый уровень ХС ЛНП ≤ 1,4 ммоль/л | < 1,4, оптимально < 1,0 | |||||||
| Очень высокий | Документированное АССЗ клинически или по результатам обследования, включая перенесенный ОКС, стабильную стенокардию, ЧКВ, КШ или другие операции на артериях, инсульт/ТИА, поражения периферических артерий АССЗ по данным инструментальных обследований – значимая АСБ (стеноз > 50%) СД + поражение органов-мишеней, ≥ 3 ФР, а также раннее начало СД 1 типа с длительностью > 20 лет Выраженная ХБП с СКФ < 30 мл/мин/1,73 м2 Оценка по шкале SCORE ≥ 10% СГХС в сочетании с АССЗ или с другими ФР |
< 1,4, оптимально < 1,0 | |||||||
| Высокий | Один значимо выраженный ФР – ХС > 8 ммоль/л и/или ХС ЛНП > 4,9 ммоль/л и/или АД ≥ 180/110 мм рт. ст. СГХС без других ФР СД без поражения органов-мишеней, СД ≥ 10 лет или с ФР Умеренная ХБП с СКФ 30–59 мл/мин/1,73 м2 Гемодинамически незначимый атеросклероз артерий (стеноз(ы) 25–49%) Оценка по шкале SCORE 5–10% |
< 1,8 и снижение ≥ 50% от исходного | |||||||
| Умеренный | Молодые пациенты (СД 1 типа – моложе 35 лет, СД 2 типа – моложе 50 лет) с длительностью СД < 10 лет без поражения органов-мишеней и ФР Оценка по шкале SCORE 1–5% |
< 2,6 | |||||||
| Низкий | – Оценка риска по шкале SCORE < 1% | < 3,0 | |||||||
Примечания: ХС ЛНП – холестерин липопротеидов низкой плотности; СД – сахарный диабет; СГХС – семейная гиперхолестеринемия; АССЗ – атеросклеротические сердечно-сосудистые заболевания; ССЗ – сердечно-сосудистые заболевания; ОКС – острый коронарный синдром; ЧКВ – чрескожное коронарное вмешательство; КШ – коронарное шунтирование; ТИА – транзиторная ишемическая атака; АСБ – атеросклеротическая бляшка; КАГ – коронарная ангиография; КТ – компьютерная томография; ФР – фактор риска; СКФ – скорость клубочковой фильтрации; SCORE – системная оценка коронарного риска (Systematic Coronary Risk Evaluation).
1 ИБС: стенокардия напряжения 3-4 ФК, нестабильная стенокардия, перенесенный инфаркт миокарда, ишемический инсульт, ЧКВ, операция КШ, ангиопластика сонных артерий или артерий нижних конечностей, каротидная эндартерэктомия, подвздошно-бедренное, бедренно-подколенное шунтирование. 2 Инфаркт миокарда, нестабильная стенокардия, перемежающаяся хромота, транзиторная ишемическая атака/ишемический инсульт. 3 Назначение статинов в максимально переносимых дозах в сочетании с эзетимибом.
Роль неинвазивных методов визуализации в оценке общего риска сердечно-сосудистых заболеваний
Визуализация коронарных артерий с помощью КТ и сонных артерий методом дуплексного сканирования являются информативными в выявлении атеросклеротического поражения артерий. Обнаружение кальцификации коронарной артерии с помощью неконтрастной КТ дает хорошую оценку атеросклеротической нагрузки и тесно связано с сердечно-сосудистыми осложнениями. КТ-ангиография коронарных артерий имеет чувствительность 95–99% и специфичность 64–83% для диагностики ИБС [9]. Для скрининга атеросклероза коронарных артерий может использоваться кальциевый индекс (КИ) по Agatston [10], что позволяет обеспечить дополнительную стратификацию риска [11], имеет меньшую стоимость, не требует внутривенного введения контрастных веществ (табл. 8).
Таблица 8. Количественная оценка индекса коронарного кальция
Использование КИ позволяет в сомнительных случаях провести реклассификацию категории
риска [12,13]. Выявление АСБ в сонной или бедренной артерии с помощью ультразвука является прогностическим фактором ССО, сравнимым с КИ [14, 15], в то время как измерение толщины комплекса интима-медиа сонной артерии не рекомендуется использовать в качестве маркера риска [16, 17].
Дуплексное сканирование сонных артерий позволяет обнаружить локализацию поражения
и количественно определить его степень и тяжесть по критериям скорости потока [18]. Более современные методы, такие как трехмерный режим, использование ультразвуковых контрастных агентов, улучшают характеристики дуплексного сканирования сонных артерий, хотя их использование ограничено [19].
У бессимптомных лиц с низким или умеренным риском выявление субклинического атеросклероза может быть основанием для назначения гиполипидемической терапии. У бессимптомных лиц с умеренным риском наличие КИ > 100 по Agatston и наличие АСБ в сонной или бедренной артерии по данным дуплексного сканирования дает основание перевести их в категорию более высокого риска (табл. 9). Следует учитывать, что КИ обычно невысок и имеет низкую специфичность у пациентов моложе 45 лет с СГХС.
Таблица 9. Рекомендации по методам визуализации для определения ССР
| Индекс коронарного кальция | Изменения коронарных артерий | Риск | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 0 | Нет признаков поражения низкий | низкий | |||||||
| 1-10 | Минимальная кальцификация | умеренный | |||||||
| 11-100 | Незначительная кальцификация. Обычно имеются АСБ с сужением просвета сосуда до 50% | высокий | |||||||
| 101-400 | Умеренная кальцификация. Обычно имеются 2–4 АСБ с сужением коронарной артерии более 50% | высокий или очень высокий | |||||||
| > 400 | Выраженная кальцификация | очень высокий | |||||||
Примечание: АСБ – атеросклеротическая бляшка.
Использование КИ позволяет в сомнительных случаях провести реклассификацию категории
риска [12,13]. Выявление АСБ в сонной или бедренной артерии с помощью ультразвука является прогностическим фактором ССО, сравнимым с КИ [14, 15], в то время как измерение толщины комплекса интима-медиа сонной артерии не рекомендуется использовать в качестве маркера риска [16, 17].
Дуплексное сканирование сонных артерий позволяет обнаружить локализацию поражения
и количественно определить его степень и тяжесть по критериям скорости потока [18]. Более современные методы, такие как трехмерный режим, использование ультразвуковых контрастных агентов, улучшают характеристики дуплексного сканирования сонных артерий, хотя их использование ограничено [19].
У бессимптомных лиц с низким или умеренным риском выявление субклинического атеросклероза может быть основанием для назначения гиполипидемической терапии. У бессимптомных лиц с умеренным риском наличие КИ > 100 по Agatston и наличие АСБ в сонной или бедренной артерии по данным дуплексного сканирования дает основание перевести их в категорию более высокого риска (табл. 9). Следует учитывать, что КИ обычно невысок и имеет низкую специфичность у пациентов моложе 45 лет с СГХС.
Таблица 9. Рекомендации по методам визуализации для определения ССР
| Факторы риска | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Наличие атеросклеротической бляшки в сонной или бедренной артерии по данным дуплексного сканирования может реклассифицировать категорию риска от низкого и умеренного до высокого | IIa | B | |||||
| Определение КИ по данным КТ коронарных артерий может реклассифицировать категорию риска от низкого и умеренного до высокого | IIa | B | |||||
Примечания: КИ – кальциевый индекс; КТ – компьютерная томография.
Коррекция факторов риска атеросклероза и его осложнений
В таблицах 10–12 представлены цели и объем мероприятий для предотвращения развития и прогрессирования атеросклероза.
Тактика ведения пациентов в зависимости от ССР и уровня ХС ЛНП представлена в таблице 13.
Для профилактики ССЗ доказали свое преимущество DASH-диета (диета для профилактики и лечения гипертонии), а также диета с преимущественным употреблением фруктов, овощей, цельнозерновых злаков и клетчатки, бобовых культур, орехов, рыбы, птицы и молочных продуктов с низким содержанием жира и ограниченным потреблением сладостей, сладких напитков и красного мяса [23, 24, 25]. Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы по крайней мере дважды в неделю и омега-3 полиненасыщенных жирных кислот (ПНЖК) в низких дозах в качестве пищевой добавки может снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеидов плазмы [26].
Таблица 10. Цели и задачи для профилактики ССЗ [5]
| Курение | Полное прекращение | |||
|---|---|---|---|---|
| Диета | Низкое содержание насыщенных жиров, предпочтение цельнозерновым продуктам, овощам, фруктам и рыбе | |||
| Антропометрия | ИМТ 20–25 кг/м2, окружность талии < 94 см (мужчины) и < 80 см (женщины) | |||
| Артериальное давление | – < 140/90 мм рт. ст. – У пациентов ≥ 65 лет или с ХБП целевой диапазон САД должен составлять 130–139 мм рт. ст., ДАД 70–80 мм рт.ст. |
|||
| ХС ЛНП | – Очень высокий риск: терапевтический режим, при котором достигается снижение уровня ХС ЛНП ≥ 50% по сравнению с исходным уровнем, а уровень ХС ЛНП < 1,4 ммоль/л (< 55 мг/дл) – Высокий риск: схема лечения, при которой достигается снижение уровня ХС ЛНП ≥ 50% по сравнению с исходным уровнем, а целевой уровень ХС ЛНП составляет < 1,8 ммоль/л (< 70 мг/дл) – Умеренный риск: целевой уровень ХС ЛНП < 2,6 ммоль/л (< 100 мг/дл) – Низкий риск: целевой уровень ХС ЛНП < 3,0 ммоль/л (< 116 мг/дл) |
|||
| ХС неЛВП | Поскольку прямое измерение ХС ЛНП имеет ограничение, особенно при метаболическом синдроме, СД, гипертриглицеридемии, то в этих случаях целесообразно использовать показатель ХС неЛВП | |||
| AпoB* | Использование показателя AпoB может быть полезным для оценки риска у людей с ГТГ, СД, ожирением или имеющим очень низкий уровень ХС ЛНП [20] | |||
| Триглицериды | Уровень < 1,7 ммоль/л (< 150 мг/дл) указывает на более низкий риск, более высокие уровни указывают на необходимость поиска причин повышения уровня триглицеридов | |||
| Липопротеид (a) | Целевого уровня для данного показателя не определен, но уровень Лп(a) > 180 мг/дл указывает на очень высокий риск, Лп(a) > 50 мг/дл – на высокий риск [21, 22 | |||
| Сахарный диабет | Гликированный гемоглобин HbA1c: < 7% (< 53 ммоль/моль) | |||
Примечания: * ХС неЛВП или апоB являются хорошими маркерами при метаболическом синдроме и диабете и могут быть вторичной целью терапии:
ХС неЛВП-C < 2,6 ммоль/л (< 100 мг/дл) и апоB < 80 мг/дл желательны для лиц с высоким риском.
ХС неЛВП < 2,2 ммоль/л (< 85 мг/дл) и апоB < 65 мг/дл у лиц с очень высоким риском.
Для лиц с очень высоким риском и с рецидивирующими ССЗ можно рассматривать достижение ХС неЛВП
< 1,8 ммоль/л (< 70 мг/дл) и апоB < 55 мг/дл.
ИМТ – индекс массы тела; ХБП – хроническая болезнь почек; САД – систолическое артериальное давление; ДАД – диастолическое артериальное давление; ХС ЛНП – холестерин липопротеидов низкой плотности; СД – сахарный диабет; неЛВП – липопротеиды невысокой плотности; АпоВ – аполипопротеин В; Лп(а) – липопротеид (а).
Таблица 11. Оптимальные значения липидных параметров в зависимости от категории риска
| Параметр | Низкий риск | Умеренный риск | Высокий риск | Очень высокий риск |
|---|---|---|---|---|
| ОХС | Рекомендовано измерение для расчета риска по SCORE | |||
| ХС ЛНП, ммоль/л |
< 3,0 | < 2,6 | < 1,8 | < 1,4 |
| ОХС | мужчины > 1,0; женщины > 1,2 | |||
| ТГ, ммоль/л | < 1,7 | |||
| Лп(а), мг/дл | < 50 | < 30 | ||
Примечания: ОХС – общий холестерин; SCORE – системная оценка коронарного риска (Systematic Coronary Risk Evaluation); ХС ЛВП – холестерин липопротеидов высокой плотности; ХС ЛНП – холестерин липопротеидов низкой плотности; ТГ – триглицериды; Лп(а) – липопротеид (а).
Таблица 12. Рекомендуемые целевые уровни ХС ЛНП в зависимости от категории риска [5]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| У пациентов экстремального риска целевой уровень ХС ЛНП < 1,0 ммоль/л и очень высокого риска целевой уровень ХС ЛНП < 1,4 ммоль/л и снижение по меньшей мере на 50% от исходного |
I | B | |||||
| У пациентов высокого риска целевой уровень ХС ЛНП < 1,8 ммоль/л и его снижение по меньшей мере на 50% от исходного |
I | B | |||||
| У пациентов умеренного риска целевой уровень ХС ЛНП < 2,6 ммоль/л | IIa | A | |||||
| У пациентов низкого риска целевой уровень ХС ЛНП < 3,0 ммоль/ | IIa | A | |||||
Примечание: ХС ЛНП – холестерин липопротеидов низкой плотности.
Таблица 13. Тактика ведения в зависимости от ССР и уровня ХС ЛНП [5]
| ХС ЛНП у пациента, не получавшего гиполипидемической терапии (ммоль/л | ||||||
| Риск | < 1,4 | 1,4–1,7 | 1,8–2,5 | 2,6–2,9 | 3,0–4,9 | ≥ 4,9 |
|---|---|---|---|---|---|---|
| Первичная профилактика | ||||||
| Низкий | ЗОЖ1 | ЗОЖ ±МТ2 | ЗОЖ ±МТ3 | |||
| Класс/Уровень | I/C | IIa/A | ||||
| Умеренный | ЗОЖ1 | ЗОЖ ±МТ2 | ЗОЖ ±МТ3 | |||
| Класс/Уровень | I/C | IIa/A | ||||
| Высокий | ЗОЖ1 | ЗОЖ ±МТ2 | ЗОЖ ±МТ3 | |||
| Класс/Уровень | IIa/A | I/A | ||||
| Высокий | ЗОЖ1 | ЗОЖ ±МТ2 | ЗОЖ ±МТ3 | |||
| Класс/Уровень | IIa/A | I/A | ||||
| Вторичная профилактика | ||||||
| Очень высокий | ЗОЖ ±МТ2 | ЗОЖ ±МТ3 | ||||
| Класс/Уровень | IIa/A | I/A | ||||
Примечания: ХС ЛНП – холестерин липопротеидов низкой плотности. ЗОЖ – здоровый образ жизни. МТ – медикаментозная терапия.
У больных ССЗ терапия статинами назначается вне зависимости от уровня ХС ЛНП в крови.
1 ЗОЖ: лечение не требуется, рекомендуется поддержание здорового образа жизни и контроль факторов риска.
2 ЗОЖ ± МТ: рекомендуется поддержание здорового образа жизни и возможно (по решению врача) назначение липидснижающей терапии, если целевой уровень ХС ЛНП не достигнут.
3 ЗОЖ + МТ: рекомендуется поддержание здорового образа жизни и одновременное назначение липидснижающей терапии.
Однако соблюдения одного лишь здорового образа жизни редко бывает достаточно для достижения целевых уровней ХС ЛНП, а это означает, что даже люди с низким и умеренным риском могут в итоге столкнуться с перспективой пожизненной терапии гиполипидемическими препаратами.
Разработаны инновационные стратегии питания для коррекции ДЛП, основанные либо на снижении потребления некоторых «рискованных» пищевых компонентов, либо на поощрении потребления «здоровых» функциональных продуктов питания и/или нутрицевтиков. Нутрицевтики (в РФ зарегистрированы как биологически активные добавки) в качестве нутритивной поддержки гипохолестеринемической диеты – это инновационный способ контроля уровня ХС ЛНП у лиц с низким и умеренным риском ССЗ.
На сегодняшний день в качестве нутрицевтика доступны препараты красного дрожжевого риса. Гипохолестеринемический эффект красного дрожжевого риса связан со статиноподобным механизмом монаколина К, который представляет собой биоактивный ингредиент. В крупном исследовании, выполненном в Китае у больных с ИБС, экстракт красного дрожжевого риса снизил частоту ССО на 45% [27]. Гипохолестеринемический эффект (снижение ХС ЛНП на 15–25%) наблюдается при ежедневном приеме 2,5–10 мг монаколина K [28].
Поликомпонентные препараты на основе красного дрожжевого риса можно применять с учетом доказанной оценки клинической эффективности, профиля безопасности и гарантированного стандарта качества у лиц низкого и умеренного риска с умеренным повышением ХС ЛНП и отсутствием показаний для приема статинов. Влияние изменения образа жизни на уровень липидов и рекомендации по диете для улучшения общего профиля липопротеидов представлены в таблицах 14 и 15.
Медикаментозная терапия дислипидемий
До начала гиполипидемической терапии важно уточнить причину ДЛП.
К средствам, корригирующим ДЛП, относятся статины, ингибиторы всасывания ХС в кишечнике (эзетимиб), ингибиторы PCSK9, фибраты, препараты, содержащие n-3-ПНЖК . Секвестранты желчных кислот и никотиновая кислота замедленного высвобождения отсутствуют в РФ.
Терапия гиперхолестеринемии
Статины являются наиболее изученными препаратами в профилактике ССЗ. Результаты многочисленных клинических исследований свидетельствуют о том, что статины значительно снижают заболеваемость и смертность от ССЗ при назначении их с целью первичной и вторичной профилактики во всех возрастных группах, как у мужчин, так и у женщин. В клинических исследованиях статины замедляли прогрессирование и даже вызывали регрессию АСБ. Крупнейший метаанализ 26 исследований с участием 170 000 пациентов показал снижение случаев инфаркта миокарда, смерти от ИБС, инсульта на 22%
при снижении уровня ХС ЛНП на 1,0 ммоль/л [29]. Имеющиеся данные позволяют предположить, что клинический эффект в значительной степени зависит не от типа статина, а от степени снижения ХС ЛНП.
При планировании гиполипидемической терапии рекомендуется придерживаться следующей схемы:
– оценить общий риск развития ССЗ у данного пациента;
– обсудить с пациентом особенности профилактики ССЗ;
– определить целевой уровень ХС ЛНП в соответствии с категорией риска;
– подсчитать в процентах степень снижения ХС ЛНП, необходимого для достижения целевого значения;
– выбрать из группы статинов препарат, который может обеспечить такой уровень снижения
ХС ЛНП;
– если монотерапия статинами не позволяет достичь цели, рассмотреть возможность комбинированной терапии.
В РФ представлены (в порядке убывания величины гиполипидемического эффекта) розувастатин в дозах 5, 10, 15, 20 и 40 мг, аторвастатин – 10, 20, 30, 40 и 80 мг/сут, питавастатин – 1, 2 и 4 мг, симвастатин – 10, 20 и 40 мг, флувастатин – 40 и 80 мг. Максимальное снижение ХС ЛНП (на 50–55%) возможно при применении высоких доз розувастатина и аторвастатина. Статины различаются по своим свойствам всасывания, биодоступности, связывания с белками плазмы, выведения и растворимости. Многие статины в значительной степени подвергаются метаболизму в печени с участием изоферментов цитохрома P450, за исключением правастатина и питавастатина [30–37].
В таблице 16 представлены дозы статинов и процент достигаемого снижения ХС ЛНП.
Эзетимиб является лекарственным средством, которое ингибирует всасывание в кишечнике
ХС, поступающего с пищей, и из желчи, не влияя на всасывание других жирорастворимых пищевых веществ. Ингибируя всасывание ХС на уровне ворсинок слизистой тонкого кишечника, эзетимиб снижает количество ХС, поступающего в печень. В ответ на снижение поступления ХС гепатоциты экспрессируют на своей поверхности большее количество рецепторов ЛНП, что сопровождается увеличением клиренса ХС ЛНП из крови. В клинических исследованиях монотерапия эзетимибом сопровождалась снижением уровня ХС ЛНП на 15–22% [38]. Комбинация эзетимиба со статинами обеспечивала дополнительное снижение уровня ХС ЛНП на 15–20%. В исследовании SHARP (Study of Heart and Renal Protection) изучалась эффективность эзетимиба в сочетании с симвастатином для лечения пациентов с ХБП.
Частота ССЗ снижалась на 17% в основной группе по сравнению с группой, получавшей плацебо [39]. Таким образом, эзетимиб может назначаться в комбинации со статинами, когда монотерапия статинами не позволяет достичь целевого уровня ХС ЛНП, а также при непереносимости статинов или наличии противопоказаний к их применению.
Таблица 14. Влияние изменения образа жизни на уровень липидов (адаптировано из Европейских рекомендаций ESC/EAS, 2019) [5]
| Изменение образа жизни для снижения уровня ОХС и ХС ЛНП | Уровень | ||||||
|---|---|---|---|---|---|---|---|
| Исключение трансжиров | ++ | A | |||||
| Снижение употребления насыщенных жиров | ++ | A | |||||
| Увеличение потребления пищевых волокон | ++ | A | |||||
| Употребление продуктов, богатых фитостеролами | ++ | A | |||||
| Красный дрожжевой рис | ++ | A | |||||
| Снижение избыточной массы тела | ++ | A | |||||
| Снижение количества холестерина с пищей | + | B | |||||
| Повышение уровня регулярной физической активности | + | B | |||||
| Изменение образа жизни для снижения уровня ТГ | |||||||
| Снижение избыточной массы тел | + | A | |||||
| Исключение алкоголя | +++ | A | |||||
| Повышение уровня регулярной физической активности | ++ | A | |||||
| Снижение общего количества углеводов, поступающих с пищей | ++ | A | |||||
| Применение омега-3 полиненасыщенных жирных кислот в качестве дополнения к диете | ++ | A | |||||
| Снижение потребления моно- и дисахаридов | ++ | B | |||||
| Замена насыщенных жиров моно- и полиненасыщенными жирами | + | B | |||||
| Изменение образа жизни для повышения уровня ХС ЛВП | |||||||
| Снижение потребления трансжиров | ++ | A | |||||
| Повышение уровня регулярной физической активности | +++ | A | |||||
| Снижение избыточной массы тела | A | ||||||
| Снижение количества углеводов, поступающих с пищей, и замена их на ненасыщенные жиры | ++ | A | |||||
| Умеренное употребление алкоголя | ++ | B | |||||
| Прекращение курения | + | B | |||||
Примечания: +++ Общее соглашение об эффективности влияния на уровень липидов. ++ Менее выраженное влияние на уровень липидов; имеющиеся свидетельства/мнения специалистов указывают на эффективность мероприятий. + Противоречивые сведения.
ОХС – общий холестерин; ХС ЛНП – холестерин липопротеидов низкой плотности; ТГ – триглицериды; ХС ЛВП – холестерин липопротеидов высокой плотности.
Таблица 15. Рекомендации по диете для улучшения общего профиля липопротеидов
| Предпочтительно | Употреблять умеренно | Употреблять редко и в ограниченных количествах | |
|---|---|---|---|
| Злаки | Цельнозерновые | Рафинированный хлеб, рис и макаронные изделия, печенье, кукурузные хлопья | Пирожные, кексы, пирожки, круассаны |
| Овощи | Сырые и обработанные овощи | Картофель | Овощи, приготовленные с маслом или сливками |
| Бобовые | Чечевица, фасоль, бобы, горох, нут, соя | ||
| Фрукты | Свежие и замороженные | Сухофрукты, желе, варенье, Консервированные фрукты, шербет, фруктовое мороженое, фруктовый сок | |
| Сладости и подсластители | Некалорийные подсластители | Сахароза, мед, шоколад, конфеты | Мороженое, фруктоза, безалкогольные напитки |
| Мясо и рыба | Постная и жирная рыба, мясо птицы без кожи | Постная вырезка говядины, баранины, свинины или телятины, морепродукты, моллюски и ракообразные | Колбасы, салями, бекон, свиные ребрышки, хот- доги, мясные субпродукты |
| Молочная пища и яйца | Обезжиренное молоко и йогурт | Молоко, сыры со сниженным содержанием жира, другие молочные продукты, яйца | Обычный сыр, сливки, цельное молоко и йогурт |
| Приправы | Уксус, горчица, обезжиренные приправы | Оливковое масло, нетропические растительные масла, мягкие маргарины, майонез, кетчуп | Трансжиры и твердые маргарины, пальмовое, кокосовое и сливочное масло, сало |
| Орехи | Все несоленые (кроме кокоса | Кокос | |
| Приготовлениепищи | Гриль, варка на пару | Гриль | Жарка |
Примечание: умеренное употребление алкоголя (не более 50 мг в день крепких напитков, 200 мг красного или белого вина и не более 350 мл пива во время приема пищи) является приемлемым при условии, что уровень ТГ не повышен, а также если отсутствует гипертоническая болезнь и/или печеночная недостаточность.
Таблица 16. Интенсивность терапии статинами
| Суточная доза статинов высокой интенсивности для ↓ ХС ЛНП ≥ 50% | Суточная доза статинов умеренной интенсивности для ↓ ХС ЛНП от 30 до 50% |
|---|---|
| Аторвастатин, 40–80 мг | Аторвастатин, 10–20 мг |
| Розувастатин, 20–40 мг | Флувастатин XL, 80 мг |
| Питавастатин, 2–4 мг | |
| Розувастатин, 5–10 мг | |
| Симвастатин, 20–40 мг |
Примечание: ХС ЛНП – холестерин липопротеидов низкой плотности.
С 2016 года в РФ одобрены к применению и с 2017 года вошли в список жизненно необходимых и важных лекарственных препаратов ингибиторы PCSK9 – белка, контролирующего экспрессию рецепторов к ХС ЛНП на гепатоцитах [40]. Повышенные уровень/функция PCSK9 снижают число рецепторов ЛНП и увеличивают концентрацию ХС ЛНП в плазме, в то время как снижение уровня/функции PCSK9 вызывает уменьшение ХС ЛНП в плазме крови [41]. Ингибиторы PCSK9 в клинических исследованиях существенно снижали уровень ХС ЛНП и, соответственно, число ССО у больных с АССЗ. В Российской Федерации одобрены к применению эволокумаб в дозировке 140 мг и алирокумаб в дозировках 75 и 150 мг в одном шприце-ручке. Оба препарата вводятся подкожно 2 раза в месяц.
Рекомендации по медикаментозной терапии ГХС представлены в таблицах 17 и 18.
В Российских рекомендациях по коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, выпущенных в 2017 году, были впервые представлены новые целевые уровни ХС ЛНП для категории очень высокого ССР [3]. Это было сделано после публикации результатов двух крупных рандомизированных
клинических исследований (РКИ), в которых было показано дополнительное снижение риска ССО при снижении уровня ХС ЛНП ниже 1,5 ммоль/л за счет добавления к статинам гиполипидемических препаратов других классов.
Таблица 17. Рекомендации по медикаментозной терапии ДЛП
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Терапия статинами в максимально переносимых дозах | I | A | |||||
| Если на фоне максимально переносимых доз статинов целевой уровень ХС ЛНП не достигнут, добавить эзетимиб | I | B | |||||
| Для вторичной профилактики у пациентов с очень высоким риском, если целевой уровень ХС ЛНП не достигнут на фоне максимально переносимых доз статинов и эзетимиба, добавить ингибитор PCSK9* | I | A | |||||
| Для первичной профилактики у пациентов с очень высоким риском, если целевой уровень ХС ЛНП не достигнут на фоне максимально переносимых доз статинов и эзетимиба, добавить ингибитор PCSK9* | I | C | |||||
| При непереносимости статинов в любой дозе следует рассмотреть назначение эзетимиба | IIа | C | |||||
| При непереносимости статинов в любой дозе можно рассмотреть добавление ингибитора PCSK9* к эзетимибу | IIа | C | |||||
Примечания: * эволокумаб или алирокумаб. ХС ЛНП – холестерин липопротеидов низкой плотности; PCSK9 – пропротеин-конвертаза субтилизин/кексин типа 9.
Таблица 18. Расчет степени снижения ХС ЛНП при различных вариантах гиполипидемической терапии
| Терапия | Снижение ХС ЛНП в % |
|---|---|
| Терапия статинами умеренной интенсивности | ≈ 30 |
| Терапия статинами высокой интенсивности | ≈ 50 |
| Терапия статинами высокой интенсивности + эзетимиб |
≈ 65 |
| Ингибиторы PCSK9 | ≈ 60 |
| Ингибиторы PCSK9 + терапия статинами высокой интенсивности |
≈ 75 |
| Ингибиторы PCSK9 + терапия статинами высокой интенсивности |
≈ 85 |
| Аферез липопротеидо | ≈ 75 |
Примечания: ХС ЛНП – холестерин липопротеидов низкой плотности; PCSK9 – пропротеин-конвертаза субтилизин/кексин типа 9.
В исследовании IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) 18144 больных, госпитализированных по поводу ОКС и имевших относительно невысокий уровень ХС ЛНП (1,3–3,2 ммоль/л или 50–125 мг/дл), получали монотерапию симвастатином или его комбинацию с эзетимибом в течение 7 лет. Через 1 год наблюдения средний уровень ХС ЛНП в группе эзетимиба составил 1,4 ммоль/л, что было на 0,4 ммоль/л меньше, чем в группе монотерапии симвастатином. В группе комбинированного лечения наблюдали значимое снижение количества смертельных исходов от сердечно-сосудистых заболеваний, инфаркта миокарда, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации и инсульта на 6,4% (ОР = 0,936; 95%, ДИ = 0,89–0,99, р = 0,016), снижение абсолютного риска на 2,0% [42].
Исследование FOURIER (Further cardiovascular OUtcomes Research with PCSK9 Inhibition in subjects with Elevated Risk) включало 27 564 пациента с атеросклеротическим поражением различных сосудистых бассейнов: 22 040 пациентов (81%) в прошлом перенесли инфаркт миокарда, у 5 330 (19%) в анамнезе был ишемический инсульт и у 3 640 (13%) – периферический атеросклероз. Пациенты находились на адекватной гиполипидемической терапии: 69,2% получали статины в режиме высокой интенсивности и 30,4% – в режиме умеренной интенсивности, у 5,1% дополнительно к статинам назначали эзетимиб. Участники, рандомизированные в группу активного лечения, получали эволокумаб подкожно в дозе 140 мг 1 раз в 2 недели или 420 мг в месяц, тогда как пациентам в группе контроля на протяжении исследования подкожно вводили плацебо [43]. Медиана наблюдения в исследовании составила 2,2 года. В группе эволокумаба уровень ХС ЛНП снизился на 59% с 2,40 ммоль/л до 0,78 ммоль/л, а риск сердечно-сосудистых осложнений снизился на 15–20% по сравнению с группой плацебо. На основании этих данных был предложен пересмотр целевого уровня ХС ЛНП для лиц очень высокого сердечно сосудистого риска [44, 45].
Позднее исследование ODYSSEY OUTCOMES (Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab) с участием 18 924 пациентов с перенесенным ОКС показало, что алирокумаб по сравнению с плацебо значимо снижал риск ССО – на 15% [46].
Таким образом, с учетом данных, полученных в перечисленных клинических исследованиях,
следует считать целесообразным и безопасным лечить пациентов очень высокого ССР до достижения целевого уровня ХС ЛНП < 1,4 ммоль/л с целью профилактики ССО.
Остаточный риск и его связь с триглицеридами
Исследователями было замечено, что, несмотря на достижение целевого уровня ХС ЛНП,
у ряда пациентов сохраняется риск ССО. Такое явление определяется как остаточный риск. Наиболее частыми причинами остаточного риска являются высокий уровень ТГ и низкий уровень ХС ЛВП в плазме крови.
По данным эпидемиологического Фремингемского исследования, уровень ТГ более 1,7 ммоль/л достоверно связан с более высоким риском развития ССО [47]. Вместе с тем риск ССО у пациентов с ХС ЛВП < 1,0 ммоль/л был на 64% выше, чем у пациентов с ХС ЛВП ≥1,4 ммоль/л [48]. Повышенные уровни ТГ и низкий уровень ХС ЛВП увеличивают риск сердечно-сосудистых осложнений у пациентов с уже достигнутым целевым уровнем ХС ЛНП [49]. Показано, что у пациентов с ТГ более 2,3 ммоль/л и ХС ЛВП менее 0,8 ммоль/л риск ССО увеличивается в 10 раз по сравнению с пациентами с оптимальными значениями ТГ и ХС ЛВП [49, 50].
По данным NCEP-ATP III, нормальное значение концентрации ТГ составляет менее 1,7 ммоль/л, промежуточно-высокий уровень ТГ находится в пределах от 1,7 до 2,3 ммоль/л, ГТГ – от 2,3 до 5,6 ммоль/л, выраженная ГТГ – более 5,6 ммоль/л [51]. Среди первичных, наследственных причин повышения ТГ выделяют варианты, связанные с гиперпродукцией ЛОНП, дефектом гидролиза ТГ, дефектом клиренса ремнантов ТГ в печени. Частым клиническим проявлением семейной ГТГ является острый панкреатит [52].
Вторичная ГТГ может быть обусловлена инсулинорезистентностью и связанными с ней состояниями – СД 2 типа, метаболическим синдромом и ожирением. При этих состояниях дислипидемия характеризуется высоким уровнем ТГ и ЛОНП и низким уровнем ХС ЛВП [50]. По данным исследования NHANES (The National Health and Nutrition Examination Survey), атерогенная ДЛП (повышенный уровень ТГ и низкий уровень ХС ЛВП) отмечается у 62% кардиологических больных [53]. Среди 22063 пациентов, получающих монотерапию статинами в Европе и Канаде, повышенный уровень ТГ и низкий уровень ХС ЛВП наблюдались у 38,8% и 26% соответственно [54]. Весьма частыми причинами повышения уровня ТГ могут быть ХБП, гипотиреоз, избыточное употребление алкоголя, системная красная волчанка, длительный прием кортикостероидов [55].
Преобладающим механизмом, лежащим в основе атеросклеротического процесса при ГТГ,
является гиперпродукция в печени частиц ЛОНП. Отмечено, что при атерогенной смешанной дислипидемии происходит формирование в большом количестве мелких, плотных ЛНП с высоко атерогенными свойствами [56].
В связи с этим у пациентов с ожирением и СД 2 типа значительно большую информацию для оценки ССР несёт ХС, не связанный с ЛВП (ХС неЛВП), рассчитываемый по формуле: ОХС – ХС ЛВП. Показатель ХС неЛВП имеет более высокий уровень прогностической значимости по сравнению с ХС ЛНП у пациентов с метаболическим синдромом и СД [57].
Обоснованную позицию в вопросе о роли ТГ и ХС ЛВП в атерогенезе показали результаты
исследования ACCORD-LIPID (The Action to Control Cardiovascular Risk in Diabetes (ACCORD)-Lipid trial) (субанализ данных пациентов с повышенным уровнем ТГ) и исследования REDUCE-IT (The Reduction of Cardiovascular Events with Icosapent Ethyl–Intervention Trial) [58, 59].
Терапия ГТГ и атерогенной дислипидемии
Современные рекомендации при выявлении ГТГ нацеливают на назначение статинов, а при недостижении целевого уровня ТГ – на добавление к терапии фибратов и n-3-ПНЖК [5, 59]. Механизмдействия фибратов заключается в активации ядерных альфа-рецепторов пероксисом (РРARα). Основная роль PPARα-рецепторов заключается в регуляции метаболизма липидов и липопротеидов, воспаления, функции эндотелия. В России из фибратов зарегистрирован фенофибрат. Назначение фенофибрата снижает уровень ТГ
на 50% и повышает уровень ХС ЛВП на 10–30% [60, 61].
В таблице 19 приводятся механизмы действия и сравнительная эффективность фенофибрата, статинов и эзетимиба по влиянию на липидный профиль.
Помимо снижения уровня ТГ фенофибрат снижает концентрацию мочевой кислоты в среднем на 25%, фибриногена – на 21%, С-реактивного белка – на 34% [60, 61].
Тактика медикаментозной терапии снижения уровня ТГ представлена в таблице 20 и на рисунке 2.
Этиловые эфиры n-3-ПНЖК эффективно снижают концентрацию ТГ и риск сердечно-сосудистых событий. Недавно завершилось исследование REDUCE-IT с участием 8179 пациентов, которое продемонстрировало снижение ОР развития неблагоприятных сердечно-сосудистых событий на 25% (р < 0,001) в группе пациентов, принимавших n-3-
ПНЖК в дозе 4 г/сут в сравнении с плацебо [59].
Таблица 19. Сравнение эффективности фенофибрата, статинов и эзетимиба [42, 51, 60, 61, 62, 63]
| Механизм действия | Фенофибрат | Статины | Эзетимиб |
|---|---|---|---|
| активирует работу клеточных PPARα-рецепторов | ингибируют фермент ГМГ-КоА-редуктазу | селективно ингибирует абсорбцию холестерина в кишечнике | |
| Снижение концентрации ХС ЛНП | 5–20% | 18–55% | 15–30% |
| Снижение уровня триглицеридов | 20–50% | 7–20% | не изменяет |
| Снижение уровня триглицеридов | 10–20% | 5–15% | 3–5% |
| Увеличение размеров частиц ЛНП | 50% | нет | нет |
Примечания: ХС ЛНП – холестерин липопротеидов низкой плотности; ХС ЛВП – холестерин липопротеидов высокой плотности
Таблица 20. Рекомендации по лекарственной терапии гипертриглицеридемии [64]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| При уровне ТГ > 2,3 ммоль/л начать терапию статинами | I | B | |||||
| С целью вторичной профилактики у пациентов, достигших целевого уровня ХС ЛНП, но с ТГ > 2,3 ммоль/л, добавить фенофибрат | IIa | B | |||||
| У больных высокого/очень высокого риска с ТГ 1,5–5,6 ммоль/л, несмотря на терапию статинами, добавить фенофибрат и при недостаточном эффекте или при непереносимости фенофибрата добавить n-3-ПНЖК 2 г × 2 раза в день | IIa | B | |||||
| У больных высокого риска, достигших целевого уровня ХС ЛНП и ТГ > 2,3 ммоль/л, добавить фенофибрат; при его непереносимости добавить n-3-ПНЖК 2 г × 2 раза в день | IIa | C | |||||
Примечания: ТГ – триглицериды; ХС ЛНП – холестерин липопротеидов низкой плотности; ПНЖК – полиненасыщенные жирные кислоты.
Рис. 2. Алгоритм лечения ГТГ [65, 66]
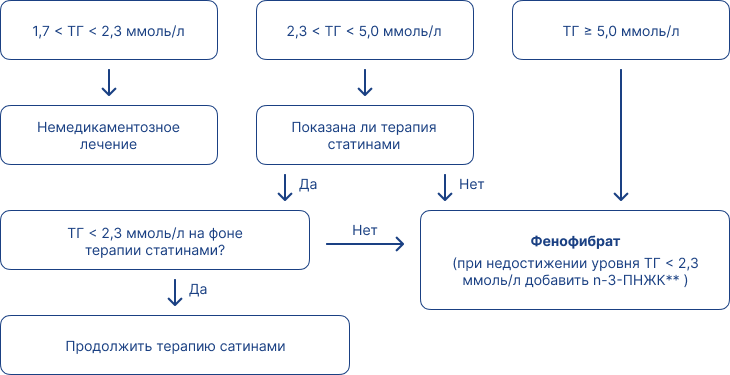
Примечания: с учетом клинического фенотипа пациента.
** n-3-ПНЖК – этиловые эфиры омега-3-полиненасыщенных жирных кислот в дозе 2–4 г/сут. При выраженной гипертриглицеридемии рассмотреть вопрос о направлении для экстракорпоральной терапии (плазмаферез).
ТГ – триглицериды.
Лечение дислипидемий у отдельных категорий пациентов
Сахарный диабет
Рекомендации по лечению ДЛП при СД представлены в таблице 21.
Согласно Российским рекомендациям по лечению СД 2019 года (IX пересмотр) гипогликемическую терапию у больных с АССЗ в сочетании с СД 2 типа следует начинать с ингибиторов натрий-глюкозного котранспортера 2-го типа или с агонистов рецепторов глюкагоноподобного пептида 1 типа с доказанным положительным влиянием на сердечно-сосудистую систему. В рандомизированных исследованиях только эмпаглифлозин и лираглутид влияли на снижение общей смертности.
Селективные ингибиторы натрий-глюкозного котранспортера 2-го типа вызывают значительное снижение уровня глюкозы в плазме как после приема пищи, так и натощак. Действие ингибиторов натрий-глюкозного котранспортера 2-го типа сохраняется в течение продолжительного времени, практически не повышает риск гипогликемии, так как не стимулирует секрецию инсулина и не подавляет синтеза эндогенной глюкозы в печени.
Увеличение экскреции глюкозы приводит к снижению уровня HbA1c; потеря калорий – к снижению массы тела (преимущественно за счет висцерального жира) и уменьшению инсулинорезистентности, а умеренный осмотический диурез и натрийурез способствуют снижению АД без возрастания симпатической активности и частоты сердечных сокращений [67]. По итогам исследования EMPA-REG Outcome (Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients) на фоне приема эмпаглифлозина в дозе 10–25 мг
продемонстрировано снижение частоты общей смертности на 32% (p< 0,001), сердечно-сосудистой смертности – на 38% (p< 0,0001) [68].
Наиболее перспективными из агонистов рецепторов глюкагоноподобного пептида 1 типа являются лираглутид и семаглутид. В 2016 г. Опубликованы результаты исследования LEADER (Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results), изучавшего эффективность и безопасность лираглутида. Это многоцентровое двойное слепое плацебоконтролируемое исследование, в котором 4668 пациентов были рандомизированы в группу лираглутида, 4672 – в группу плацебо. Частота сердечно-сосудистой смерти была ниже в группе лираглутида (4,7%), чем в группе плацебо (6,0%) (p = 0,007). Продемонстрировано снижение количества случаев коронарной реваскуляризации, нестабильной стенокардии, госпитализации по поводу сердечной недостаточности на 20% [69].
Семаглутид имеет 94% гомологии с человеческим глюкагоноподобным пептидом 1 типа, но
в отличие от него имеет продленный период полувыведения, что позволяет вводить его подкожно 1 раз в неделю. Влияние терапии семаглутидом на сердечно-сосудистые исходы изучалось в исследовании SUSTAIN-6 (A Long-term, Randomised, Double-blind, Placebo-controlled, Multinational, Multicentre Trial to Evaluate Cardiovascular and Other Longterm Outcomes With Semaglutide in Subjects With Type 2 Diabetes), в котором 3297 пациентов с СД 2 типа и высоким ССР были рандомизированы в группы семаглутида (0,5 или 1 мг 1 раз в неделю) или плацебо в дополнение к стандартной противодиабетической и сердечно-сосудистой терапии. Срок наблюдения составил 104 недели. Выявлено снижение частоты инсультов на 38%, при этом препарат не уменьшал частоты общей и сердечно-сосудистой смертности, нефатального ИМ и госпитализации по поводу СН [70].
Рекомендации по ведению пациентов с СД 2 типа для контроля ССР представлены в таблице 22 [68, 69, 71, 72].
Таблица 21. Коррекция ДЛП у больных СД [5]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| У пациентов с СД 2 типа очень высокого риска – снижение ХС ЛНП ≥ 50%, целевой уровень ХС ЛНП < 1,4 ммоль/л | I | A | |||||
| У пациентов с СД 2 типа высокого риска – снижение ХС ЛНП ≥ 50%, целевой уровень ХС ЛНП < 1,8 ммоль/л | I | A | |||||
| Статины рекомендованы при СД 1 типа лицам с высоким и очень высоким риском | I | A | |||||
| Терапия статинами высокой интенсивности рекомендована до начала комбинированной терапии | IIa | C | |||||
| Если целевой уровень ХС ЛНП не достигнут, рекомендовано к статину добавить эзетимиб | IIa | B | |||||
| Терапия статинами не рекомендована пациенткам с СД и планируемой беременностью или не принимавшим контрацептивы | III | C | |||||
| Терапия статинами может быть назначена пациентам с СД 1 типа и СД 2 типа ≤30 лет с поражением органов-мишеней и/или уровнем ХС ЛНП > 2,5 ммоль/л | IIb | C | |||||
| Поскольку прямое измерение ХС ЛНП имеет ограничение, особенно при метаболическом синдроме, СД, гипертриглицеридемии, то в этих случаях целесообразно использовать показатель ХС неЛВП | I | C | |||||
| ХС неЛВП или апоB являются хорошими маркерами при метаболическом синдроме и СД и могут быть вторичной целью терапии | I | C | |||||
| При ТГ 1,5–5,6 ммоль/л, несмотря на терапию статинами, добавить фенофибрат и при недостаточном эффекте или при непереносимости фенофибрата добавить n-3-ПНЖК 2 г × 2 раза в день | IIa | B | |||||
| При ТГ 1,5–5,6 ммоль/л, несмотря на терапию статинами, добавить фенофибрат и при недостаточном эффекте или при непереносимости фенофибрата добавить n-3-ПНЖК 2 г × 2 раза в день | IIa | B | |||||
Примечания: СД – сахарный диабет; ХС ЛНП – холестерин липопротеидов низкой плотности.
Семейная гиперхолестеринемия
СГХС – это наследственное аутосомно-доминантное заболевание, обусловленное мутациями генов, регулирующих экспрессию рецепторов к ЛНП (LDLR), апобелка В100 (APOB), профермента PCSK9 (PCSK9), сопровождающееся стойким повышением уровня ХС ЛНП и ранним развитием атеросклероза. Заболевание проявляется в виде
двух форм – гетерозиготной и гомозиготной [73].
В диагностике гетерозиготной СГХС целесообразно руководствоваться критериями, предложенными голландскими экспертами. Рекомендации по выявлению и лечению гетерозиготной СГХС представлены в таблицах 23 и 24.
Медикаментозное лечение СГХС у взрослых
Целью терапии СГХС является достижение уровня ХС ЛНП < 1,4 ммоль/л при наличии ИБС,
СД, или атеросклероза сонных или периферических артерий (наличие АСБ со стенозом > 50%) и < 1,8 ммоль/л при их отсутствии. Взрослым пациентам рекомендуется назначать терапию статинами высокой интенсивности: аторвастатин 80 мг/сут или розувастатин 40 мг/сут. У лиц старше 18 лет с гетерозиготной СГХС при недостаточной эффективности статинов в максимально переносимых дозах рекомендуется добавить эзетимиб 10 мг. Если и в этом случае не удается достичь целевого уровня ХС ЛНП или его снижения на 50% от исходного значения, рекомендуется рассмотреть вопрос о назначении ингибиторов PCSK9 (эволокумаб 140 мг п/к каждые 2 недели или 420 мг один раз в месяц или алирокумаб 75/150 мг п/к каждые 2 недели) [5, 73].
Таблица 22. Рекомендации по ведению пациентов с СД 2 для контроля сердечно-сосудистого риска
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Эмпаглифлозин, канаглифлозин, дапаглифлозин и ипраглифлозин рекомендуются для снижения риска новых сердечно-сосудистых событий у пациентов с СД 2 и ССЗ, имеющих очень высокий и высокий ССР | I | A | |||||
| Эмпаглифлозин рекомендуется у пациентов с СД 2 типа и ССЗ для снижения риска смерти | I | A | |||||
| Лираглутид, семаглутид и дулаглутид рекомендуются для снижения риска новых сердечно-сосудистых событий у пациентов с СД 2 типа и ССЗ, имеющих очень высокий и высокий ССР | I | A | |||||
| Лираглутид рекомендуется у пациентов с СД 2 типа и ССЗ для снижения риска сердечно-сосудистой смерти | I | A | |||||
| Метформин рекомендуется назначать пациентам с СД 2 типа без ССЗ, относящихся к категории низкого и умеренного ССР | I | A | |||||
Примечания: СД 2 – сахарный диабет 2 типа; ССЗ – сердечно-сосудистое заболевание; ССР – сердечно-сосудистый рис
Таблица 23. Голландские диагностические критерии гетерозиготной СГХС [73]
| Рекомендации | Уровень | ||||||
|---|---|---|---|---|---|---|---|
| 1. Наследственный анамнез | |||||||
| Раннее (у мужчин < 55 лет; у женщин < 60 лет) развитие ССЗ или уровень ХС ЛНП выше 95-й процентили у ближайшего родственника | 1 | ||||||
| Наличие сухожильных ксантом у ближайшего родственника или уровень ХС ЛНП выше 95-й процентили у детей младше 18 лет 2 | 2 | ||||||
| 2. Персональный анамнез | |||||||
| Раннее развитие ССЗ (у мужчин < 55 лет; у женщин < 60 лет) | 2 | ||||||
| Раннее развитие атеросклеротического поражения церебральных/периферических артерий (у мужчин < 55 лет; у женщин < 60 лет) | 1 | ||||||
| 3. Физикальное обследованиеа | |||||||
| Сухожильные ксантомы | 6 | ||||||
| Липидная дуга роговицы < 45 лет | 4 | ||||||
| 4. Уровень ХС ЛНП | |||||||
| > 8,5 ммоль/л 8 | 8 | ||||||
| 6,5–8,4 ммоль/л 5 | 5 | ||||||
| 4,9–6,4 ммоль/л 3 | 3 | ||||||
| 4,0–4,8 ммоль/л 1 | 1 | ||||||
| 5. Анализ ДНК | |||||||
| Функциональная мутация генов LDLR, APOB или PCSK9 8 | 8 | ||||||
| Диагноз ставится на основании суммы баллов: «определенная» СГХС – > 8 баллов | 5 | ||||||
| «предположительная» ИЛИ «вероятная» СГХС – 6-8 баллов «возможная» СГХС – 3-5 баллов | 3 | ||||||
Примечания: а Исключают друг друга (т. е. максимум 6 баллов). ССЗ – сердечно-сосудистое заболевание; ХС ЛНП – холестерин липопротеидов низкой плотности; СГХС – семейная гиперхолестеринемия; PCSK9 – пропротеин-конвертаза субтилизин/кексин типа 9.
Таблица 24. Рекомендации по выявлению и лечению гетерозиготной СГХС [73]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Наличие СГХС следует заподозрить в случае развития ССЗ у мужчин моложе 50 лет и женщин моложе 55 лет при наличии в семье случаев раннего развития ССЗ, сухожильных ксантом или у пациентов с существенно повышенным уровнем ХС ЛНП (у взрослых > 5 ммоль/л, у детей > 4 ммоль/л) при наличии СГХС у родственников 1-й линии | I | C | |||||
| Рекомендуется подтверждать диагноз клиническими критериями и при возможности - результатами генетического анализа | I | C | |||||
| При выявлении случая гетерозиготной СГХС показано проведение каскадного скрининга | I | C | |||||
| В случае наличия СГХС и АССЗ (очень высокий риск) – снизить ХС ЛНП ≥ 50%, целевой уровень ХС ЛНП < 1,4 ммоль/л | I | C | |||||
| Лечение ингибиторами PCSK9 рекомендуется у пациентов очень высокого риска с СГХС, если целевой уровень ХС ЛНП не достигнут на максимально переносимых дозах статина в комбинации с эзетимибом | I | C | |||||
| Дети с СГХС должны соблюдать диету с низким содержанием насыщенных жиров, медикаментозную терапию следует начинать в возрасте старше 8–10 лет. Целевой уровень ХС ЛНП при этом – < 3,5 ммоль/л | IIa | C | |||||
Примечания: СГХС – семейная гиперхолестеринемия; ССЗ – сердечно-сосудистое заболевание; PCSK9 – пропротеин конвертаза субтилизин/кексин типа 9; ИБС – ишемическая болезнь сердца; ХС ЛНП – холестерин липопротеидов низкой плотности; ФР – факторы риска.
Медикаментозная терапия СГХС у детей
Медикаментозную гиполипидемическую терапию у детей с СГХС следует начинать с 8–10-летнего возраста на фоне соблюдения низкожировой диеты. Рекомендуемый целевой уровень ХС ЛНП у детей 8–10 лет – < 4,0 ммоль/л, у детей старше 10 лет – < 3,5 ммоль/л. Начинать медикаментозную терапию следует с назначения статинов в низких дозах, постепенно титруя их до оптимальных доз. Клинические исследования подтвердили безопасность и эффективность лечения детей статинами.
Гомозиготная СГХС – заболевание, при котором уровень ХС ЛНП без лечения превышает
13 ммоль/л и CCЗ развиваются в детском или юношеском возрасте [73].
Терапия начинается с назначения статинов в максимально переносимой дозе, при отсутствии желаемого эффекта к статинам добавляют эзетимиб и/или ингибиторы PCSK9 (эволокумаб у детей старше 12 лет подкожно 140 мг каждые 2 недели или 420 мг один раз в месяц). В особо тяжелых случаях к медикаментозной терапии рекомендуется добавить экстракорпоральные методы лечения (иммуносорбция ЛНП или каскадная плазмофильтрация). Лечение и наблюдение детей с СГХС должно проводиться совместно педиатром и кардиологом.
Аферез липопротеидов
Врачи направляют кандидатов на проведение афереза липопротеидов (ЛП-аферез) в медицинские учреждения, проводящие экстракорпоральные методы удаления атерогенных липопротеидов. ЛП-аферез назначается пациентам, у которых после 6 месяцев комбинированной гиполипидемической терапии в максимально переносимых дозах не достигнуты целевые уровни ХС ЛНП и/ или Лп(а) (табл. 25).
Аферез проводится еженедельно или 1 раз в две недели. Во время процедуры из плазмы
крови пациента удаляется до 80% ХС ЛНП и/или Лп(а). В настоящее время существует несколько методов ЛП-афереза: каскадная плазмофильтрация, липидная фильтрация, гепарин-преципитация ЛНП (HELP), аффинная плазмо- и гемосорбция липопротеидов, иммуносорбция ЛНП и Лп(а).
Терапия дислипидемий у женщин
Статины с целью вторичной профилактики назначают женщинам по тем же показаниям, что и мужчинам. Применение гиполипидемических препаратов противопоказано при планировании беременности, во время беременности и в период грудного вскармливания.
Женщины репродуктивного возраста:
– во время лечения должны пользоваться адекватными методами контрацепции;
– женщины с СГХС должны получить консультацию по отмене гиполипидемических средств не позднее чем за 4 недели до прекращения предохранения от беременности и не должны принимать эти препараты до окончания грудного вскармливания;
– в случае незапланированной беременности женщина с СГХС должна незамедлительно прекратить прием любых гиполипидемических средств и проконсультироваться со своим лечащим врачом в отношении возможностей коррекции ДЛП без ущерба для развивающегося плода (диета, иммуносорбция ЛНП).
Терапия дислипидемий у пожилых
Количество лиц пожилого и старческого возраста в популяции с каждым годом увеличивается. Более 80% пациентов, умерших от коронарной патологии, были в возрасте старше 65 лет. Число пациентов с ИМ старше 85 лет возросло в несколько раз [74]. Результаты метаанализа о связи уровня ХС в крови с сосудистой смертностью указывают на то, что высокий ХС является существенным ФР смерти от ИБС во всех возрастных группах, но эта связь ослабевает у пожилых людей. Снижение ОХС на 1 ммоль/л (38,7 мг/дл) было ассоциировано со снижением смертности от ИБС на 56% в возрастной группе 40–49 лет по сравнению со снижением на 15% в группе лиц 80–89 лет [75, 76]. Однако, несмотря на относительное снижение риска у пожилых пациентов, увеличение частоты ИБС означает, что абсолютное число ССО, связанных с ДЛП, является самым высоким в этой группе. Сведения о лечении пациентов в возрасте 80–85 лет очень ограничены, при подборе терапии пациентам старческого возраста следует руководствоваться клинической ситуацией.
Оптимальным подходом является проведение профилактических мероприятий в течение всей жизни, что в итоге ведет к снижению частоты ССЗ в популяции [77, 80]. Однако ни одно исследование по первичной профилактике не было специально направлено на пожилое население [81]. Доступные данные основаны на анализе подгрупп из контролируемых исследований. В недавно опубликованном метаанализе показаны результаты восьми исследований, в которые были включены 24 674 пациента старше 65 лет [82]. Лечение статинами снизило частоту инфаркта миокарда на 39% и инсульта – на 24%.
В исследование по вторичной профилактике PROSPER (Pravastatin in Elderly Individuals at Risk of Vascular Disease study) включали пациентов 70–82 лет с наличием или высоким риском ССЗ [83].
Таблица 24. Рекомендации по выявлению и лечению гетерозиготной СГХС [73]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Гомозиготная форма СГХС – абсолютное показание | I | A | |||||
| Гетерозиготная форма СГХС, тяжелое течение. Недостаточный эффект от медикаментозной терапии; непереносимость лекарственных препаратов | I | A | |||||
| Другие формы ГХС, рефрактерные к максимальной медикаментозной терапии у больных с ИБС | I | C | |||||
| Гиперлипопротеидемия (а) (> 60 мг/дл) у больных с ИБС, особенно в сочетании с рефрактерной к терапии ГХС | I | B | |||||
| Рефрактерная к терапии ГХС у больных, перенесших реваскуляризацию, с целью предотвращения рестенозов и окклюзий шунтов и стентов | IIa | C | |||||
| Рефрактерная дислипидемия у беременных с высоким риском осложнений, особенно с наследственной формой дислипидемии, гипер Лп(а), выраженной гипервязкостью крови | I | C | |||||
Примечания: СГХС – семейная гиперхолестеринемия; ГХС – гиперхолестеринемия; ИБС – ишемическая болезнь сердца; Лп(а) – липопротеид (а).
Процедуры афереза липопротеидов проводятся только в специализированных отделениях клиник.
Пациенты получали правастатин 40 мг в день или плацебо. Число случаев ИБС снизилось на 15% в группе, принимавшей правастатин, в то же время значимого снижения случаев инсульта не было. В исследовании SAGE (Study Assessing Goals in the Elderly) 893 пациента 65–83 лет со стабильной ИБС получали лечение аторвастатином в дозе 80 мг/сут или правастатином 40 мг/сут [84]. В группе аторвастатина отмечена более низкая смертность от всех причин и имелась тенденция к снижению случаев, связанных с патологией коронарных артерий. В исследованиях 4S (The Scandinavian Simvastatin Survival Study) и HPS (The Heart Protection Study) у пациентов старше 65 лет наблюдалось, на фоне терапии симвастатином в сравнении с плацебо, снижение риска ССО, сопоставимое с более молодыми лицами [85, 86]. Рекомендации по лечению ДЛП у пациентов пожилого возраста представлены в таблице 26.
Таблица 26. Рекомендации по лечению ДЛП у пациентов пожилого возраста
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Терапия статинами рекомендована у пожилых лиц с АССЗ так же, как и у более молодых пациентов | I | A | |||||
| Терапия статинами рекомендована для первичной профилактики в соответствии с категорией риска у лиц ≤ 75 лет | I | A | |||||
| Можно рассматривать терапию статинами у лиц > 75 лет при наличии высокого или очень высокого риска | IIb | B | |||||
| Рекомендуется начинать терапию статинами с низких доз в случае наличия значимого поражения функции почек и/или возможности лекарственных взаимодействий, а затем постепенно увеличивать дозу до достижения целевых показателей ХС ЛНП | I | C | |||||
Примечание: АССЗ – атеросклеротические сердечно-сосудистые заболевания.
Пациенты с острым коронарным синдромом и кандидаты на чрескожные коронарные вмешательства
У пациентов, недавно перенесших ОКС, повышен риск дальнейшего развития ССО. Результаты клинических исследований подтверждают целесообразность раннего проведения терапии статинами [32, 78, 79]. Рекомендуется назначать статины в высоких дозах в течение первых 4 дней госпитализации больных с ОКС. Если известен исходный уровень ХС ЛНП, дозу препаратов следует подбирать для достижения уровня ХС ЛНП
< 1,4 ммоль/л. Менее интенсивная терапия статинами показана пациентам пожилого возраста, при нарушении функции печени или почек, а также в случае возможного лекарственного взаимодействия с другими лекарственными препаратами.
Уровень липидов в крови следует повторно оценивать через 4–6 недель после развития ОКС для определения того, достигнуты ли целевые значения, а также для оценки безопасности лечения.
Прием n-3-ПНЖК в виде высокоочищенного этилового эфира эйкозапентаеновой кислоты, по данным исследования REDUCE-IT, способствовал снижению смертности пациентов, перенесших ИМ [80].
В метаанализе 13 рандомизированных исследований с участием 3341 пациента было показано, что предварительная терапия высокими дозами статинов у пациентов, ранее их не получавших (11 исследований), либо применение высокой дозы статинов у пациентов, получающих постоянную терапию статинами, демонстрирует уменьшение частоты перипроцедурного инфаркта миокарда и улучшение исходов в 30-дневный срок после чрес кожного коронарного вмешательства (ЧКВ) [81]. Стратегию нагрузочной терапии или повышения дозы на фоне постоянной терапии статинами следует рассматривать при плановой ЧКВ в случае стабильной ИБС или ОКС без подъема сегмента ST (класс IIa, уровень А). Предварительная терапия статинами также эффективна в снижении риска контрастиндуцированной нефропатии после коронарной ангиографии или ЧКВ [82].
Рекомендации по гиполипидемической терапии у пациентов с ОКС и у пациентов, перенесших ЧКВ, приведены в таблице 27
Таблица 27. Рекомендации по лечению ДЛП у пациентов с ОКС и пациентов, которым планируется выполнение ЧКВ
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| У всех пациентов с ОКС при отсутствии противопоказаний или установленной непереносимости рекомендуется начать или продолжить терапию статинами в высоких дозах как можно раньше, вне зависимости от исходных значений ХС ЛНП | I | A | |||||
| Уровни липидов должны быть проконтролированы через 4–6 недель после ОКС для того, чтобыоценить достижение целевых показателей по снижению ХС ЛНП (на 50% от исходного и < 1,4 ммоль/л). В это же время необходимо провести оценку безопасности терапии статинами и при необходимости скорректировать дозы препаратов | IIa | C | |||||
| Если на фоне терапии максимально переносимыми дозами статинов через 4–6 недель не достигнуты целевые уровни ХС ЛНП, рекомендуется добавить эзетимиб | I | B | |||||
| Если на фоне терапии максимально переносимыми дозами статинов и эзетимибом через 4–6 недель не достигнуты целевые уровни ХС ЛНП, рекомендуется комбинация с ингибиторами PCSK9 | I | B | |||||
| У пациентов с противопоказаниями к терапии статинами или подтвержденной непереносимостью статинов следует назначить эзетимиб | IIa | C | |||||
| У пациентов с ОКС, которые при поступлении имеют уровень ХС ЛНП выше целевого, несмотря на терапию максимально переносимыми дозами статинов и эзетимибом, следует рассмотреть назначение ингибиторов PCSK9 (при возможности во время текущей госпитализации) | IIa | C | |||||
Примечания: ОКС – острый коронарный синдром; ХС ЛНП – холестерин липопротеидов низкой плотности; PCSK9 – пропротеин-конвертаза субтилизин/кексин типа 9.
Пациенты с хронической болезнью почек
У пациентов с ХБП и установленным ССЗ гораздо более высокий уровень смертности по сравнению с пациентами с ССЗ и нормальной функцией почек. Очевидно, что пациенты с ХБП имеют высокий (ХБП 3-й стадии) или очень высокий (ХБП 4–5 или на диализе) ССР. В исследовании SHARP комбинированная терапия симвастатином и эзетимибом у лиц с ХБП стадий 3А-5 снижала риск развития ССО (коронарная смерть, ИМ, ишемический инсульт
или реваскуляризация) по сравнению с плацебо [87] (табл. 28).
Таблица 28. Адаптация рекомендаций по ведению пациентов с нарушениями липидного обмена при ХБП [88]
| Рекомендации | Класс | Уровень | |||||
|---|---|---|---|---|---|---|---|
| Пациенты с ХБП 3–5 стадий имеют высокий или очень высокий ССР | I | A | |||||
| Использование статинов или комбинации статин/эзетимиб рекомендуется у пациентов ХБП 3–5 стадий, не находящихся на гемодиализе | I | A | |||||
| У пациентов, уже получающих статины, эзетимиб или комбинацию статин/эзетимиб и направленных на хронический гемодиализ, не рекомендуется прерывать проводимую терапию | I | A | |||||
| У пациентов c ХБП, находящихся на гемодиализе и не имеющих АССЗ, начинать терапию статинами не рекомендуется | I | A | |||||
Примечания: ХБП – хроническая болезнь почек; АССЗ – атеросклеротические сердечно-сосудистые заболевания; ССР – сердечно-сосудистый риск.
На начальных стадиях ХБП уровни ТГ обычно повышены, а уровни ХС ЛВП снижены; преобладают подклассы мелких плотных частиц ЛНП. Исследования показывают, что почки также играют значительную роль в катаболизме Лп(a). Концентрация Лп(a) в крови увеличивается в связи с заболеванием почек и может снижаться после трансплантации почки или ремиссии нефротического заболевания.
Статины не показаны пациентам с ревматическими заболеваниями, пороками сердца,
дегенеративным стенозом аортального клапана в отсутствие показаний.
Контроль за эффективностью и переносимостью гиполипидемической терапии
Ответ пациента на терапию рекомендуется оценивать через 6–8 недель после начала приема статинов или при изменении дозы препарата; Стандартная практика последующего мониторинга предполагает проведение повторного анализа через 6–12 месяцев. Минимальный объем исследований включает определение ОХС, ХС ЛВП, ТГ, расчет ХС ЛНП и желательно липопротеида (а). Целесообразно наряду с определением липидного профиля оценивать отношение пациентов к соблюдению рекомендаций, касающихся изменения образа жизни и приема лекарственных препаратов.
Побочные явления гиполипидемической терапии
Миалгия и миопатия – наиболее часто встречающиеся побочные явления терапии статинами
[84]. В метаанализе РКИ их частота в группе терапии статинами не возрастала [89], тогда как в наблюдательных исследованиях отмечено колебание в пределах от 10 до 15% [90, 91].
Активность в плазме крови аланинаминотрасферазы (АЛТ) и аспартатаминотрансферазы (АСТ) определяется для оценки функционального состояния печени. При заболеваниях печени по АЛТ судят об активности поражения: минимальная активность – повышение в 1,5–4 раза, умеренная активность – повышение в 5–10 раз, высокая активность – ≥ 10 раз.
Еще одно важное побочное явление, связанное с приемом статинов – развитие в некоторых случаях СД. Все эти обстоятельства требуют тщательного контроля в процессе терапии статинами.
Рекомендации по мониторингу липидов и ферментов у пациентов до и на фоне гиполипидемической терапии
Тестирование липидов.При уровне ТГ > 4,5 ммоль/л определение ХС ЛНП следует проводить прямым методом.
Как часто следует проверять липиды?- Перед началом гиполипидемической терапии следует провести как минимум два измерения с интервалом в 1–12 недель, за исключением состояний, при которых рекомендуется немедленная лекарственная терапия (ОКС и пациенты с очень высоким риском).
Как часто следует тестировать липиды пациента после начала гиполипидемической терапии?
- После начала лечения – через 8 (± 4) недель.
- После коррекции лечения (изменение дозы и/или комбинированной терапии – каждые 8 (± 4) недель до достижения целевого уровня.
Как часто следует тестировать липиды после достижения целевого или оптимального уровня липидов?
- Ежегодно (при отсутствии проблем с приверженностью пациента или других конкретных причин более частого мониторинга).
Мониторинг печеночных и мышечных ферментов
Как часто контролировать печеночные ферменты (АЛТ)?- До лечения.
- Через 8–12 недель после начала медикаментозной терапии или после увеличения дозы препарата.
- Рутинный контроль AЛT не рекомендуется во время лечения статинами, за исключением случаев наличия симптомов, свидетельствующих о патологии печени. Во время лечения фибратами рекомендуется контролировать уровень АЛТ
Что делать, если повышается уровень печеночных ферментов? Если AЛT < 3 верхних границ нормы (ВГН)
- Продолжать терапию.
- Повторный контроль АЛТ – через 4–6 недель.
Если AЛT > 3 ВГН
- Прекратить гиполипидемическую терапию или уменьшить дозу и повторить анализ на печеночные ферменты в течение 4–6 недель.
- С осторожностью повторно начать терапию возможно после нормализации уровня АЛТ.
- Если AЛT остается повышенным, необходимо выявлять другие причины.
Как часто следует измерять активность креатинфосфокиназы (КФК)?
- Перед началом терапии.
- Если исходный уровень КФК > 4 ВГН, не назначать лекарственную терапию – необходимо
- повторить исследование.
Мониторинг
- Рутинный мониторинг КФК не требуется.
- Необходим контроль КФК при развитии у пациента миалгии.
Необходимо быть внимательными в отношении развития миопатии и повышения уровня КФК у пациентов группы риска: пожилые пациенты, пациенты, получающие сопутствующую терапию, большое количество препаратов, имеющие заболевания печени или почек, спортсмены.
Что делать, если уровень КФК повышается и возникает миалгия? Если уровень КФК > 4 ВГН:- Прекратить приём статинов на 6 недель. Назначить другой статин в низкой дозе.
Что делать, если уровень КФК повышается и возникает миалгия? Если уровень КФК > 4 ВГН:
- Прекратить приём статинов на 6 недель. Назначить другой статин в низкой дозе.
Если уровень КФК < 4 ВГН
- Прекратить приём статинов на 2 недели. Если симптомы сохраняются, требуется замена статина на другой липидснижающий препарат и поиск других причин симптомов.
- Если симптомы прошли, следует назначить другой статин в низкой/умеренной дозе. В случае возобновления симптомов назначить третий статин. В обоих случаях при недостижении целевого уровня ХС ЛНП (поскольку доза статина была уменьшена) добавить к терапии эзетимиб, а при необходимости – алирокумаб или эволокумаб.
У каких пациентов следует проверять уровень HbA1c или уровень глюкозы в крови?
- Следует регулярно проверять наличие HbA1c или глюкозы у пациентов с высоким риском развития СД и при лечении статинами в высоких дозах.
- Группы для контроля уровня глюкозы: пожилые и пациенты с метаболическим синдромом, ожирением или другими признаками резистентности к инсулину.
Следует помнить, что вирусные гепатиты, алкогольный гепатит, цирроз печени, токсическое повреждение печени лекарствами и при отравлениях, длительный прием хлорпромазина, инфекционный мононуклеоз, неалкогольная жировая болезнь печени, стеатогепатит, холестаз сопровождаются повышением АЛТ. При остром инфаркте миокарда отмечается повышение уровня АСТ через 4–8 часов после болевого приступа, которое сохраняется в течение 3–6 дней. АCТ также может повышаться при застойной сердечной недостаточности, после операций на сердце, после реанимационных мероприятий. К другим состояниям, приводящим
к увеличению уровня АСТ, относятся мышечная дистрофия, повреждения мышц, панкреатит, миокардит, перикардит, гемолитическая анемия, инфаркт легкого, гипотиреоз, синдром Рея [92, 93, 94].
При использовании статинов рекомендуется регулярно выполнять лабораторные исследования, включая определение уровней АЛТ и КФК перед началом лечения для выявления тех немногочисленных пациентов, которым лечение противопоказано. Уровень КФК следует определять пациентам из группы повышенного риска развития миопатии, например пожилым людям с сопутствующей патологией, пациентам, у которых раньше наблюдались симптомы миалгии, или принимающим препараты, с которыми возможно развитие лекарственного взаимодействия. Гепатотоксичность у пациентов, принимающих статины, наблюдалась крайне редко в крупных РКИ, а долгосрочная терапия статинами безопасна [95, 96, 97].
Рутинное повторное определение уровня КФК не обладает прогностической ценностью для выявления рабдомиолиза, так как уровень данного фермента может повышаться при повреждении мышц или чрезмерной мышечной нагрузке. Уровень КФК следует немедленно определять у пациентов, особенно пожилых, с болями в мышцах и мышечной слабости лечение необходимо прекратить при уровне КФК, в 10 раз превышающем ВГН (см. рекомендации по мониторингу липидов и ферментов на стр. 32).
В связи с возможным риском возникновения сахарного диабета на фоне лечения статинами следует рассматривать регулярную проверку уровня HbA1C (1 раз в 3 месяца) у пациентов с высоким риском развития СД, таких как пожилые люди или пациенты с метаболическим синдромом, ожирением или признаками резистентности к инсулину (см. стр. 32).
Заключение
Причиной большинства ССЗ является атеросклероз. Повлиять на развитие этих заболеваний
можно только, воздействуя на основное их патогенетическое звено – ДЛП. За последние годы в диагностике и терапии атеросклероза достигнуты значительные успехи. Усовершенствованы биохимические, инструментальные и генетические методы диагностики. Были разработаны инновационные стратегии питания для коррекции ДЛП с включением в рацион функциональных продуктов и/или нутрицевтиков. Настоящий прорыв
произошел в разработке принципиально новых лекарственных средств на основе моноклональных антител, генно-инженерных конструкций. Эти препараты обещают внести вклад в снижение сердечно-сосудистой заболеваемости и смертности, которые в России остаются высокими. Основная проблема в лечении заболеваний, вызванных атеросклерозом, состоит в том, что чаще всего терапию начинают только при появлении клинических симптомов. В частности, коррекция основных ФР начинается лишь при манифестации стенокардии или ОКС, в то же время пациенты с начальным атеросклерозом коронарных, сонных, артерий нижних конечностей во многих случаях остаются недообследованными и не получают рекомендаций по изменению образа жизни
и приему необходимых препаратов – вот почему проблема выявления, профилактики и лечения атеросклероза остается крайне актуальной. Авторы надеются, что изложенные рекомендации окажут существенную помощь кардиологам, врачам общей практики и другим специалистам в рациональной диагностике, профилактике и терапии заболеваний атеросклеротического генеза.
Основу научных и практических данных для текущих рекомендаций составили:
1. Ezhov M. V., Sergienko I. V., Aronov D. M., Arabidze G. G., Akhmedzhanov N. M., Bazhan S. S.,
Balakhonova T. V., Barbarash O. L., Boytsov S. A., Bubnova M. G, Voevoda M. I., Galyavich A. S., Gornyakova N. B., Gurevich V. S., Drapkina O. M., Duplyakov D. V., Eryogin S. Ya., Zubareva M. Yu.,
Karpov R. S., Karpov Yu. A., Koziolova N. A., Konovalov G. A., Konstantinov V. O., Kosmacheva E. D., Martynov A. I., Nebieridze D. V., Pokrovsky S. N., Ragino Yu. I., Skibitsky V. V., Smolenskaya O. G., Chazova I. E., Shalnova S. A., Shaposhnik I. I., Kukharchuk V. V. Diagnosis and correction of lipid
metabolism disorders in order to prevent and treat atherosclerosis. Atherosclerosis and dyslipidemia. 2017; 3 (28): 5–22. Russian (Ежов М. В., Сергиенко И. В., Аронов Д. М., Арабидзе Г. Г., Ахмеджанов Н. М., Бажан С.С., Балахонова Т. В., Барбараш О. Л., Бойцов С .А., Бубнова М. Г., Воевода М. И., Галявич А. С., Горнякова Н. Б., Гуревич В. С., Драпкина О. М., Дупляков Д. В., Ерёгин С. Я., Зубарева М. Ю., Карпов Р. С., Карпов Ю. А., Козиолова Н. А., Коновалов Г. А., Константинов В. О., Космачева Е. Д., Мартынов А. И., Небиеридзе Д. В., Покровский С. Н., Рагино Ю. И., Скибицкий В. В., Смоленская О. Г., Чазова И. Е., Шальнова С. А., Шапошник И. И., Кухарчук В. В. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Атеросклероз и дислипидемии. 2017; 3(28): 5–22).
2. Mach F., Baigent C., Catapano A. L., Koskinas K. C., Casula M., Badimon L., Chapman M. J., De Backer G. G., Delgado V, Ference B. A., Graham I. M., Halliday A., Landmesser U., Mihaylova B.,
Pedersen T. R., Riccardi G, Richter D. J., Sabatine M. S., Taskinen M-R, Tokgozoglu L., Wiklund O. 2019 ESC/ EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111–188. doi/10.1093/ eurheartj/ehz455.
3. Cosentino F., Grant P. J., Aboyans V., Bailey C. J., Ceriello A., Delgado V., Federici M, Filippatos G., Grobbee D. E., Hansen T. B., Huikuri H. V., Johansson I, Jüni P, Lettino M., Marx N., Mellbin L. G., Ostgren C. J., Rocca B., Roffi M., Sattar N., Seferovi P. M., Sousa-Uva M., Valensi P., Wheeler D. C. 2019 ESC Guidelines on diabetes, pre-diabetes,and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020;41(2):255–323. doi: 10.1093/eurheartj/ ehz486
Список литературы
1. Healthcare development strategy in the Russian Federation for the period until 2025. Decree of the President of the Russian Federation of June 6 , 2019 No. 254. Moscow , 2019. In Russian. (Стратегия развития здравоохранения в Российской Федерации на период до 2025 года. Указ Президента Российской Федерации от 06 июня 2019 г. №254. Москва , 2019).
2. Russia in numbers 2019. A brief statistical compilation. M.: Rosstat. 2019. In Russian. (Россия в цифрах 2019. Краткий статистический сборник. М.: Росстат. 2019).
3. Ezhov M.V. , Sergienko I.V. , Aronov D.M. , Arabidze G.G. , Akhmedzhanov N.M. , Bazhan S.S. , Balakhonova T.V. , Barbarash O.L. , Boytsov S.A. , Bubnova M.G. , Voevoda M.I. , Galyavich A.S. , Gornyakova N.B. , Gurevich V.S. , Drapkina O.M. , Duplyakov D.V. , Eryogin S.Ya. , Zubareva M.Yu. , Karpov R.S. , Karpov Yu.A. , Koziolova N.A. , Konovalov G.A. , Konstantinov V.O. , Kosmacheva E.D., Martynov A.I. ,Nebieridze D.V. , Pokrovsky S.N. , Ragino Yu.I. , Skibitsky V.V. , Smolenskaya O.G. , Chazova I.E. , Shalnova S.A. , Shaposhnik I.I. , Kukharchuk V.IN. Diagnosis and correction of l ipid
metabol ism disorders in order to prevent and treat atherosclerosis. Atherosclerosis and dysl ipidemia. 2017.3 (28): 5–22. Russian (Ежов М.В. , Сергиенко И.В. , Аронов Д.М. , Арабидзе Г.Г. , Ахмеджанов Н.М. , Бажан С.С. , Балахонова Т.В. , Барбараш О.Л. , Бойцов С.А. , Бубнова М.Г., Воевода М.И. , Галявич А.С. , Горнякова Н.Б. , Гуревич В.С. ,Драпкина О.М. , Дупляков Д.В. , Ерёгин С.Я. , Зубарева М.Ю. , Карпов Р.С. , Карпов Ю.А. , Козиолова Н.А. , Коновалов Г.А. , Константинов В.О. , Космачева Е.Д. ,Мартынов А.И. ,Небиеридзе Д.В. ,Покровский С.Н. , Рагино Ю.И. , Скибицкий В.В. , Смоленская О.Г. , Чазова И.Е. ,Шальнова С.А. ,Шапошник И.И. , Кухарчук В.В. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Атеросклероз и дислипидемии. 2017; 3(28): 5–22).
4. Piepol i M.F. ,Hoes A.W. , Agewall S. , Albus C. , Brotons C. , Catapano A.L. , Cooney M.T. , Corrа U. , Cosyns B. , Deaton C. , Graham I. ,Hall M.S. ,Hobbs FDR. , Løchen M.L. , Lцllgen H. ,Marques-Vidal P. , Perk J. , Prescott E. , Redon J. , Richter D.J. , Sattar N. , Smulders Y. , Tiberi M. , van der Worp H.B. , van Dis I. , Verschuren WMM. , Binno S.; ESC Scientific Document Group. 2016 European Guidel ines on cardiovascular disease prevention in cl inical practice. Eur Heart J. 2016; 37(29): 2315–2381. doi: 10.1093/eurheartj/ehw106.
5. Mach F. , Baigent C. , Catapano A.L. , Koskinas K.C. , Casula M. , Badimon L. , Chapman M.J. , De Backer G.G. , Delgado V. , Ference B.A. , Graham I.M. ,Hall iday A. , Landmesser U. ,Mihaylova B. , Pedersen T.R. , Riccardi G. , Richter D.J. , Sabatine M.S. , Taskinen M.R. , Tokgozoglu L. ,Wiklund O.; ESC Scientific Document Group. 2019 ESC/EAS Guidel ines for the management of dysl i pidaemias: l i pid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111–188. doi: 10.1093/eurheartj/ehz455.
6. Langsted A. ,Nordestgaard B.G. Nonfasting versus fasting l ipid profile for cardiovascular risk prediction. Pathology. 2019; 51(2): 131–141. doi: 10.1016/j.pathol.2018.09.062.
7. Farukhi Z. ,Mora S. The Future of Low-Density Lipoprotein Cholesterol in an Era of Nonfasting Lipid Testing and Potent Low-Density Li poprotein Lowering. Circulation. 2018. 137(1): 20–23. doi: 10.1161/ CIRCULATIONAHA.117.031857.
8. Langsted A. ,Nordestgaard B.G. Nonfasting Lipids , Lipoproteins , and Apol ipoproteins in Individuals with and without Diabetes: 58 434 Individuals from the Copenhagen General Population Study. Cl in Chem. 2010; 57(3): 482–489. doi: 10.1373/cl inchem.2010.157164.
9. Meijboom W.B. ,Meijs M.F. , Schuijf J.D. , Cramer M.J. ,Mollet N.R. , van Mieghem C.A. ,Nieman K. , van Werkhoven J.M. , Pundziute G. ,Weustink A.C. , de Vos A.M. , Pugl iese F. , Rensing B. , Jukema J.W. , Bax J.J. , Prokop M. , Doevendans P.A. , Hunink M.G. , Krestin G.P. , de Feyter P.J. Diagnostic accuracy of 64-sl ice computed tomography coronary angiography: a prospective ,multicenter ,multivendor study. J Am Coll Cardiol. 2008; 52(25): 2135–2144. doi: 10.1016/j.jacc.2008.08.058.
10. Agatston A.S. , Janowitz W.R. ,Hildner F.J. , Zusmer N.R. , Viamonte M. Jr. , Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol. 1990; 15(4): 827–832. doi: 10.1016/0735–1097(90)90282-t.
11. Serrano C.V. , de Mattos F.R. , Pitta F.G. ,Nomura C.H. , de Lemos J. , Ramires J.A.F. , Kal il-Filho R. Association between Neutrophil-Lymphocyte and Platelet-Lymphocyte Ratios and Coronary Artery Calcification Score among Asymptomatic Patients: Data from a Cross-Sectional Study. Mediators Inflamm. 2019 Mar 26;2019:6513847. doi: 10.1155/2019/6513847.
12. Perk J. , De Backer G. , Gohlke H. , Graham I. , Reiner Z. , Verschuren W.M. , Albus C. , Benl ian P. , Boysen G. , Cifkova R. , Deaton C. , Ebrahim S. , Fisher M. , Germano G. ,Hobbs R. ,Hoes A. , Karadeniz S. ,Mezzani A. , Prescott E. , Ryden L. , Scherer M. , Syvдnne M. , Scholte Op Reimer W.J. , Vrints C. ,Wood D. , Zamorano J.L. , Zannad F.; Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Cl inical Practice; European Association for Cardiovascular Prevention and Rehabil itation European Guidel ines on cardiovascular disease prevention in cl inical practice (version 2012). Atherosclerosis. 2012; 223(1): 1–68. doi: 10.1016/j.atherosclerosis.2012.05.007.
13. Mortensen M.B. , Falk E. , Li. D. ,Nasir K. , Blaha M.J. , Sandfort V. , Rodriguez C.J. , Ouyang P. , Budoff M. Statin Trials , Cardiovascular Events , and Coronary Artery Calcification. JACC Cardiovascular Imaging. 2018; 11(2): 221–230. doi: 10.1016/j.jcmg.2017.01.029.
14. McDermott M.M. , Kramer C.M. , Tian L. , Carr J , Guralnik J.M. , Polonsky T. , Carroll T. , Kibbe M. , Criqui M.H. , Ferrucci L. , Zhao L. ,Hippe D.S. ,Wilkins J. , Xu D. Liao Y. ,McCarthy W. , Yuan C. Plaque Composition in the Proximal Superficial Femoral Artery and Peri pheral Artery Disease Events. JACC Cardiovascular Imaging. 2017; 10(9): 1003–1012. doi: 10.1016/j.jcmg.2016.08.012.
15. Sillesen H. , Sartori S. , Sandholt B. , Baber U. ,Mehran R. , Fuster V. Carotid plaque thickness and carotid plaque burden predict future cardiovascular events in asymptomatic adult Americans. European Heart Journal – Cardiovascular Imaging. 2017; 19(9): 1042–1050. doi: 10.1093/ehjci/jex239.
16. Perrone-Filardi P. , Achenbach S. ,Mohlenkamp S. , Reiner Z. , Sambuceti G. , Schuijf J.D. , Van der Wall E. , Kaufmann P.A. Knuuti J. , Schroeder S. , Zellweger M.J. Cardiac computed tomography and myocardial perfusion scintigraphy for risk stratification in asymptomatic individuals without known cardiovascular disease: a position statement of the Working Group on Nuclear Cardiology and Cardiac CT of the European Society of Cardiology. Eur Heart J. 2010; 32(16): 1986–1993. doi: 10.1093/eurheartj/ehq235.
17. Den Ruijter H.M. , Peters S.A.E. , Anderson T.J. , Britton A.R. , Dekker J.M. , Eijkemans M.J. , Engstrцm G. , Evans G.W. , de Graaf J. , Grobbee D.E. ,Hedblad B. ,Hofman A. ,Holewijn S. , Ikeda A., Kavousi M. , Kitagawa K. , Kitamura A. , Koffijberg H. , Lonn E.M. , Lorenz M.W. ,Mathiesen E.B., Nijpels G. , Okazaki S. , O'Leary D.H. , Polak J.F. , Price J.F. , Robertson C. , Rembold C.M. , Rosvall M. , Rundek T. , Salonen J.T. , Sitzer M. , Stehouwer C.D. ,Witteman J.C. ,Moons K.G. , Bots ML. Common Carotid Intima-Media Thickness Measurements in Cardiovascular Risk Prediction. JAMA. 2012; 308(8): 796–803. doi: 10.1001/jama.2012.9630.
18. Stein J.H. , Korcarz C.E. ,Hurst R.T. , Lonn E. , Kendall C.B. ,Mohler E.R. ,Najjar S.S. , Rembold C.M. , Post W.S.; American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Use of Carotid Ultrasound to Identify Subcl inical Vascular Disease and Evaluate Cardiovascular Disease Risk: A Consensus Statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force Endorsed by the Society for Vascular Medicine. J Am Soc Echocardiogr. 2008; 21(2): 93–111. doi: 10.1016/j.echo.2007.11.011.
19. Vlachopoulos C. , Xaplanteris P. , Aboyans V. , Brodmann M. , Cífková R. , Cosentino F. , De Carlo M. , Gall ino A. , Landmesser U. , Laurent S. , Lekakis J. ,Mikhail idis D.P. ,Naka K.K. , Protogerou A.D. , Rizzoni D. , Schmidt-Trucksäss A. , Van Bortel L. ,Weber T. , Yamashina A. , Ziml ichman R. , Boutouyrie P. , Cockcroft J. , O'Rourke M. , Park J.B. , Schillaci G. , Sillesen H. , Townsend R.R. The role of vascular biomarkers for primary and secondary prevention. A position paper from the European Society of Cardiology Working Group on peri pheral circulation. Atherosclerosis. 2015; 241(2): 507–532. doi: 10.1016/j.atherosclerosis.2015.05.007.
20. Robinson J.G. ,Will iams K.J. , Gidding S. , Borén J. , Tabas I. , Fisher E.A. , Packard C. , Pencina M. , Fayad Z.A. ,Mani V. , Rye K.A. ,Nordestgaard B.G. , Tybjærg-Hansen A. , Douglas P.S. ,Nicholls S.J. , Pagidipati N. , Sniderman A. Eradicating the Burden of Atherosclerotic Cardiovascular Disease by Lowering Apol i poprotein B Li poproteins Earl ier in Life. J Am Heart Assoc. 2018; 7(20): e009778. doi: 10.1161/JAHA.118.009778.
21. Kamstrup P.R. Lipoprotein(a): the common , l ikely causal , yet elusive risk factor for cardiovascular disease. J Li pid Res. 2017; 58(9): 1731–1732. doi: 10.1194/jlr.c079111.
22. Tsimikas S. , Fazio S. , Ferdinand K.C. , Ginsberg H.N. , Koschinsky M.L. ,Marcovina S.M., Moriarty P.M. , Rader D.J. , Remaley A.T. , Reyes-Soffer G. , Santos R.D. , Thanassoul is G. ,Witztum J.L. , Danthi S. , Ol ive M. , Liu L. NHLBI Working Group Recommendations to Reduce Li poprotein(a)-Mediated Risk of Cardiovascular Disease and Aortic Stenosis. J Am Coll Cardiol. 2018; 71(2): 177–192. doi: 10.1016/j.jacc.2017.11.014.
23. Eckel R.H. , Jakicic J.M. , Ard J.D. , de Jesus J.M. ,Houston Miller N. ,Hubbard V.S. , Lee I.M. , Lichtenstein A.H. , Loria C.M. , Millen B.E. ,Nonas C.A. , Sacks F.M. , Smith S.C. Jr , Svetkey L.P., Wadden T.A. , Yanovski S.Z. , Kendall K.A. ,Morgan L.C. , Trisol ini M.G. , Velasco G. ,Wnek J. , Anderson J.L. ,Halperin J.L. , Albert N.M. , Bozkurt B. , Brindis R.G. , Curtis L.H. , DeMets D., Hochman J.S. , Kovacs R.J. , Ohman E.M. , Pressler S.J. , Sellke F.W. , Shen W.K. , Smith S.C. , Jr , Tomasell i G.F. 2013 AHA/ACC Guidel ine on Lifestyle Management to Reduce Cardiovascular Risk. Circulation. 2013; 129(25 suppl 2): S76-S99. doi: 10.1161/01.cir.0000437740.48606.d1.
24. de Lorgeril M. , Salen P. ,Martin J.-L. ,Monjaud I. , Delaye J. ,Mamelle N. Mediterranean Diet , Traditional Risk Factors, and the Rate of Cardiovascular Compl ications After Myocardial Infarction. Circulation. 1999; 99(6): 779–785. doi: 10.1161/01.cir.99.6.779.
25. Estruch R. , Ros E. , Salas-Salvado J. , Covas M.I. , Corella D. , Arуs F. , Gуmez-Gracia E. , Ruiz-Gutiйrrez V. , Fiol M. , Lapetra J. , Lamuela-Raventos R.M. , Serra-Majem L. , Pintу X. , Basora J. , Muсoz M.A. , Sorlн J.V. ,Martнnez J.A. , Fitу M., Gea A. ,Hernбn M.A. ,Martнnez-González M.A. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Ol ive Oil or Nuts. N Engl J Med. 2018; 378(25): e34. doi: 10.1056/ NEJMoa1800389.
26. Mozaffarian D. , Lemaitre R.N. , King I.B. , Song X. ,Huang H. , Sacks F.M. , Rimm E.B. ,Wang M , Siscovick D.S. Plasma Phosphol i pid Long-Chain ω-3 Fatty Acids and Total and Cause-Specific Mortal ity in Older Adults. Ann Intern Med. 2013; 158(7): 515–525. doi: 10.7326/0003–4819–158–7-201304020–00003.
27. Lu Z. , Kou W. , Du B. ,Wu Y. , Zhao S. , Brusco O.A. ,Morgan J.M. , Capuzzi D.M.; Chinese Coronary Secondary Prevention Study Group , Li S. Effect of Xuezhikang , an Extract From Red Yeast Chinese Rice , on Coronary Events in a Chinese Population With Previous Myocardial Infarction. Am J Cardiol. 2008; 101(12): 1689–1693. doi: 10.1016/j. amjcard.2008.02.056
28. Li Y. , Jiang L. , Jia Z. , Xin W. , Yang S. , Yang Q. ,Wang L. A Meta-Analysis of Red Yeast Rice: An Effective and Relatively Safe Alternative Approach for Dysl i pidemia. PLoS One. 2014; 9(6): e98611. doi: 10.1371/journal. pone.0098611.
29. Cholesterol Treatment Trial ists’ (CTT) Collaboration , Baigent C. , Blackwell L. , Emberson J., Holland L.E. , Reith C. , Bhala N. , Peto R. , Barnes E.H. , Keech A. , Simes J. , Coll ins R. Cholesterol Treatment Trial ists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: A meta-analysis of data from 170 000 partici pants in 26 randomised trials. Lancet. 2010; 376(9753): 1670–1681.
30. Sever P.S. , Dahlцf B. , Poulter N.R. , et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations , in the Anglo-Scandinavian Cardiac Outcomes Trial—Li pid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet. 2003; 361(9364): 1149–1158. doi: 10.1016/s0140–6736(03)12948–0.
31. Colhoun H.M. , Betteridge D.J. , Durrington P.N. ,Wedel H. , Beevers G. , Caulfield M. , Coll ins R.,Kjeldsen S.E. , Kristinsson A. ,McInnes G.T. ,Mehlsen J. ,Nieminen M , O'Brien E. , Ostergren J.; ASCOT investigators. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet. 2004; 364(9435): 685–696. doi: 10.1016/s0140–6736(04)168955.
32. Pedersen T.R. , Faergeman O. , Kastelein J.J. , Olsson A.G. , Tikkanen M.J. ,Holme I. , Larsen M.L.,Bendiksen F.S. , Lindahl C. , Szarek M. , Tsai J.; Incremental Decrease in End Points Through Aggressive Lipid Lowering (IDEAL) Study Group. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437–2445.
33. Boekholdt S.M. ,Hovingh G.K. ,Mora S. , Arsenault B.J. , Amarenco P. , Pedersen T.R. , LaRosa J.C. ,Waters D.D. , DeMicco D.A. , Simes R.J. , Keech A.C. , Colquhoun D. ,Hitman G.A. , Betteridge D.J. , Clearfield M.B. , Downs J.R. , Colhoun H.M. , Gotto A.M. Jr. , Ridker P.M. , Grundy S.M. , Kastelein J.J. Very low levels of atherogenic l ipoproteins and the risk for cardiovascular events: a meta-analysis of statin trials. J Am Coll Cardiol. 2014;64:485–494.
34. Ridker P.M. , Danielson E. , Fonseca F.A. , Genest J. , Gotto A.M. Jr. , Kastelein J.J. , Koenig W. , Libby P. , Lorenzatti A.J. , MacFadyen J.G. ,Nordestgaard B.G. , Shepherd J. ,Willerson J.T. , Glynn R.J.; JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359:2195–2207.
35. Yusuf S. , Bosch J. , Dagenais G. , Zhu J. , Xavier D. , Liu L. , Pais P. , Lуpez-Jaramillo P. , Leiter L.A. , Dans A. , Avezum A. , Piegas LS. , Parkhomenko A. , Keltai K. , Keltai M. , Sl iwa K. , Peters R.J., Held C. , Chazova I. , Yusoff K. , Lewis B.S. , Jansky P. , Khunti K. , Toff W.D. , Reid C.M. , Varigos J. , Sanchez-Vallejo G. ,McKelvie R. , Pogue J. , Jung H. , Gao P. , Diaz R. , Lonn E.; HOPE-3 Investigators. Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease. N Engl J Med. 2016;374(21):2021–2031. doi: 10.1056/NEJMoa1600176.
36. Taguchi I. , Iimuro S. , Iwata H. , Takashima H. , Abe M. , Amiya E. , Ogawa T. , Ozaki Y. , Sakuma I. ,Nakagawa Y. ,Hibi K. , Hiro T. , Fukumoto Y. ,Hokimoto S. ,Miyauchi K. , Yamazaki T. , Ito H. , Otsuji Y. , Kimura K. , Takahashi J. ,Hirayama A. , Yokoi H. , Kitagawa K. , Urabe T. , Okada Y. , Terayama Y. , Toyoda K. ,Nagao T. ,Matsumoto M. , Ohashi Y. , Kaneko T. , Fujita R. , Ohtsu H. , Ogawa H. , Daida H. , Shimokawa H. , Saito Y. , Kimura T. , Inoue T. ,Matsuzaki M. ,Nagai R. High- Dose Versus Low-Dose Pitavastatin in Japanese Patients With Stable Coronary Artery Disease (REAL-CAD): A Randomized Superiority Trial. Circulation. 2018;137(19):1997–2009. doi: 10.1161/CIRCULATIONAHA.117.032615.
37. Amarenco P. , Bogousslavsky J. , Callahan A. , Goldstein L.B. ,Hennerici M. , Rudolph A.E., Sillesen H. , Simunovic L., Szarek M. ,Welch K.M. , Zivin J.A.; Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med. 2006; 355(6): 549–559. doi: 10.1056/NEJMoa061894.
38. Pandor A. , Ara R.M. , Tumur I. ,Wilkinson A.J. , Paisley S. , Duenas A. , Durrington P.N. , Chilcott J. Ezetimibe monotherapy for cholesterol lowering in 2,722 people: systematic review and meta-analysis of randomized controlled trials. J Intern Med. 2009 May;265(5):568–580. doi: 10.1111/j.1365–2796.2008.02062.x.
39. Baigent C. , Landray M.J. , Reith C. , Emberson J. ,Wheeler D.C. , Tomson C. ,Wanner C. , Krane V. , Cass A. , Craig J. ,Neal B. , Jiang L. ,Hooi L.S. , Levin A. , Agodoa L. , Gaziano M. , Kasiske B., Walker R. ,Massy Z.A. , Feldt-Rasmussen B. , Krairittichai U. , Ophascharoensuk V , Fellström B., Holdaas H. , Tesar V. ,Wiecek A. , Grobbee D. , de Zeeuw D. , Grönhagen-Riska C. , Dasgupta T. , Lewis D. ,Herrington W. ,Mafham M. ,Majoni W. ,Wallendszus K. , Grimm R. , Pedersen T. , Tobert J. , Armitage J. , Baxter A. , Bray C. , Chen Y. , Chen Z. ,Hill M. , Knott C. , Parish S. , Simpson D. , Sleight P. , Young A. , Coll ins R.; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181–2192. doi: 10.1016/S0140–6736(11)60739–3.
40. Abifadel M. , Varret M. , Rabиs J.-P. , Allard D. , Ouguerram K. , Devillers M. , Cruaud C. , Benjannet S. ,Wickham L. ,
Erl ich D. , Derré A. , Villéger L. , Farnier M. , Beucler I. , Bruckert E. , Chambaz J. , Chanu B. , Lecerf J.M. , Luc G. ,Moul in P. , Weissenbach J. , Prat A. , Krempf M. , Junien C. , Seidah N.G. , Boileau C. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003; 34(2): 154–156. doi: 10.1038/ng1161.
41. Norata G.D. , Tibolla G. , Catapano A.L. Targeting PCSK9 for Hypercholesterolemia. Annual Review of Pharmacology and Toxicology. 2014; 54(1): 273–293. doi: 10.1146/annurev-pharmtox-011613–140025.
42. Cannon C.P. , Blazing M.A. , Giugl iano R.P. ,McCagg A. ,White J.A. , Theroux P. , Darius H. , Lewis B.S. , Ophuis T.O. , Jukema J.W. , De Ferrari G.M. , Ruzyllo W. , De Lucca P. , Im K. , Bohula E.A. , Reist C. ,Wiviott S.D. , Tershakovec A.M. , Musl iner T.A. Braunwald E. , Cal iff R.M.; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015; 372(25): 2387–2397. doi: 10.1056/NEJMoa1410489.
43. Sabatine M.S. , Giugl iano R.P. , Keech A.C. ,Honarpour N. ,Wiviott S.D. ,Murphy S.A. , Kuder J.F., Wang H. , Liu T. , Wasserman S.M. , Sever P.S. , Pedersen T.R.; FOURIER Steering Committee and Investigators. Evolocumab and Cl inical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017; 376(18): 1713–1722. doi: 10.1056/ nejmoa1615664.
44. Giugl iano R.P. , Pedersen T.R. , Park J.-G. , De Ferrari G.M. , Gaciong Z.A. , Ceska R. , Toth K. Gouni-Berthold I. , Lopez-Miranda J. , Schiele F. ,Mach F. , Ott B.R. , Kanevsky E. , Pineda A.L. , Somaratne R. ,Wasserman S.M. , Keech A.C. , Sever P.S. , Sabatine M.S.; FOURIER Investigators. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet. 2017; 390(10106): 1962–1971. doi: 10.1016/s0140–6736(17)32290–0.
45. Boekholdt S.M. ,Hovingh G.K. ,Mora S. , Arsenault B.J. , Amarenco P. , Pedersen T.R. , LaRosa J.C. ,Waters D.D. , DeMicco D.A., Simes R.J. , Keech A.C. , Colquhoun D. ,Hitman G.A. , Betteridge D.J. , Clearfield M.B. , Downs J.R. , Colhoun H.M. , Gotto A.M. Jr. , Ridker P.M. , Grundy S.M. , Kastelein J.J. Very Low Levels of Atherogenic Lipoproteins and the Risk for Cardiovascular Events. J Am Coll Cardiol. 2014; 64(5): 485–494. doi: 10.1016/j.jacc.2014.02.615.
46. Schwartz G.G. , Steg P.G. , Szarek M. , Bhatt D.L. , Bittner V.A. , Diaz R. , Edelberg J.M. , Goodman S.G. ,Hanotin C. , Harrington R.A. , Jukema J.W. , Lecorps G. ,Mahaffey K.W. ,Moryusef A. , Pordy R. , Quintero K. , Roe M.T. , Sasiela W.J. , Tamby J.F. , Tricoci P. ,White H.D. , Zeiher A.M.; ODYSSEY OUTCOMES Committees and Investigators. Al irocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018; 379(22): 2097–2107. doi: 10.1056/NEJMoa1801174.
47. Castell i W.P. Epidemiology of triglycerides: A view from Framingham. Am J Cardiol. 1992; 70(19): H3-H9. doi:10.1016/0002–9149(92)91083-g.
48. Barter P. , Gotto A.M. , LaRosa J.C. ,Maroni J. , Szarek M. , Grundy S.M. , Kastelein J.J. , Bittner V. , Fruchart J.C.; Treating to New Targets Investigators. HDL Cholesterol , Very Low Levels of LDL Cholesterol , and Cardiovascular Events. N Engl J Med. 2007; 357(13): 1301–1310. doi: 10.1056/nejmoa064278.
49. Carey V.J. , Bishop L. , Laranjo N. ,Harshfield B.J. , Kwiat C. , Sacks F.M. Contribution of High Plasma Triglycerides and Low High-Density Li poprotein Cholesterol to Residual Risk of Coronary Heart Disease After Establ ishment of Low-Density Li poprotein Cholesterol Control. Am J Cardiol. 2010; 106(6): 757–763. doi: 10.1016/j. amjcard.2010.05.002.
50. Aguiar C. , Alegria E. , Bonadonna R.C. , Catapano A.L. , Cosentino F. , El isaf M. , Farnier M. , Ferriиres J. , Filardi P.P. , Hancu N. , Kayikcioglu M. ,Mello E. , Silva A. ,Millan J. , Reiner Ž., Tokgozoglu L. , Valensi P. , Viigimaa M. , Vrabl ik M. ,Zambon A. , Zamorano J.L. , Ferrari R. A review of the evidence on reducing macrovascular risk in patients with atherogenic dysl i pidaemia: A report from an expert consensus meeting on the role of fenofibrate–statin combination therapy. Atheroscler Suppl. 2015; 19: 1–12. doi: 10.1016/s1567–5688(15)30001–5.
51. National Cholesterol Education Program Expert Panel on Detection E , Treatment of High Blood Cholesterol in A. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection , Evaluation , and
Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002; 106(25): 3143–3421.
52. Hegele R.A. , Ginsberg H.N. , Chapman M.J. ,Nordestgaard B.G. , Kuivenhoven J.A. , Averna M. , Borén J. , Bruckert E. , Catapano A.L. , Descamps O.S. ,Hovingh G.K. ,Humphries S.E. , Kovanen P.T., Masana L. , Pajukanta P. , Parhofer K.G. , Raal F.J. , Ray K.K. , Santos R.D. , Stalenhoef A.F. , Stroes E. , Taskinen M.R. , Tybjærg-Hansen A. ,Watts G.F. ,Wiklund O. European Atherosclerosis Society Consensus Panel.. The polygenic nature of hypertriglyceridaemia: impl ications for definition , diagnosis , and management. Lancet Diabetes Endocrinol. 2014; 2(8): 655–666. doi: 10.1016/S2213– 8587(13)70191–8.
53. Ghandehari H. , Kamal-Bahl S. ,Wong N.D. Prevalence and extent of dysl ipidemia and recommended l ipid levels in US adults with and without cardiovascular comorbidities: The National Health and Nutrition Examination Survey 2003–2004. Am Heart J. 2008; 156(1): 112–119. doi: 10.1016/j.ahj.2008.03.005.
54. Gitt A.K. , Drexel H. , Feely J. , Ferriиres J. , Gonzalez-Juanatey J.R. , Thomsen K.K. , Leiter L.A. , Lundman P. , da Silva P.M. , Pedersen T., Wood D. , Jünger C. , Dellea P.S. , Sazonov V. , Chazelle F. , Kastelein J.J.; DYSIS Investigators. Persistent lipid abnormal ities in statin-treated patients and predictors of LDL-cholesterol goal achievement in cl inical practice in Europe and Canada. Eur J Prev Cardiol. 2011; 19(2): 221–230. doi: 10.1177/1741826711400545.
55. Yuan G. , Al-Shal i K.Z. ,Hegele R.A. Hypertriglyceridemia: its etiology , effects and treatment. Can Med Assoc J.2007; 176(8): 1113–1120. doi: 10.1503/cmaj.060963.
56. Reaven G.M. , Chen Y.D. , Jeppesen J. ,Maheux P. , Krauss R.M. Insul in resistance and hyperinsul inemia in individuals with small , dense low density l ipoprotein particles. J Cl in Invest. 1993; 92(1): 141–146. doi: 10.1172/jci116541.
57. Ridker P.M. , Rifai N. , Cook N.R. , Bradwin G., Buring J.E. Non–HDL Cholesterol , Apol ipoproteins A-I and B100 , Standard Lipid Measures , Lipid Ratios , and CRP as Risk Factors for Cardiovascular Disease in Women. JAMA. 2005; 294(3): 326. doi: 10.1001/jama.294.3.326.
58. Effects of Combination Li pid Therapy in Type 2 Diabetes Mell itus. N Engl J Med. 2010; 362(17): 1563–1574.doi: 10.1056/nejmoa1001282.
59. Bhatt D.L. , Steg P.G. ,Miller M. , Brinton E.A. Jacobson T.A. , Ketchum S.B. , Doyle R.T. Jr , Jul iano R.A. , Jiao L. , Granowitz C. , Tardif J.C. , Ballantyne C.M.; REDUCE-IT Investigators. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med. 2019; 380(1): 11–22. doi: 10.1056/nejmoa1812792.
60. Fruchart J.C. , Duriez P. Mode of action of fibrates in the regulation of triglyceride and HDL-cholesterol metabol ism. Drugs of Today. 2006; 42(1): 39. doi: 10.1358/dot.2006.42.1.963528.
61. Keating G.M. , Croom K.F. Fenofibrate. Drugs. 2007; 67(1): 121–153. doi: 10.2165/00003495–200767010–00013 62. Cholesterol Treatment Trial ists’ (CTT) Collaboration , Baigent C. , Blackwell L. , Emberson J. ,Holland L.E. , Reith C. , Bhala N. , Peto R. Barnes E.H. , Keech A. , Simes J. , Coll ins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 partici pants in 26 randomised trials. Lancet. 2010; 376(9753): 1670–1681. doi: 10.1016/S0140–6736(10)61350–5.
63. Mark L. , Dani G. , Fazekas Ö. , Szüle O. , Kovacs H. , Katona A. Effects of ezetimibe on l ipids and l ipoproteins in patients with hyper cholesterolemia and different apol i poprotein E genotypes. Curr Med Res Opin. 2007. 23(7): 1541–1548. doi: 10.1185/030079907x199817.
64. Kim N.H. ,Han K.H. , Choi J. , Choi J. , Lee J. , Kim S.G. Use of fenofibrate on cardiovascular outcomes in statin users with metabol ic syndrome: propensity matched cohort study. BMJ. 2019; 366: l5125. doi: 10.1136/bmj.l5125.
65. Effect of fenofibrate on progression of coronary-artery disease in type 2 diabetes: the Diabetes
Atherosclerosis Intervention Study , a randomised study. Lancet. 2001; 357(9260): 905–910. doi: 10.1016/s0140– 6736(00)04209–4.
66. Best J. , Scott R. , Taskinen M.R. , Forder P. , Pillai A. , Davis T. , Glasziou P. , Drury P. , Kesдniemi Y.A. , Sull ivan D. ,Hunt D. , Colman P. , d'Emden M. ,Whiting M. , Ehnholm C. , Laakso M.; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mell itus (the FIELD study): randomised controlled trial. Lancet. 2005; 366(9500): 1849–1861. doi: 10.1016/s0140–6736(05)67667–2.
67. Kovacs C.S. , Seshiah V. , Swallow R. , Jones R. , Rattunde H. ,Woerle H.J. , Broedl U.C.; EMPA-REG PIO™ trial investigators. Empagl iflozin improves glycaemic and weight control as add-on therapy to piogl itazone or piogl itazone plus metformin in patients with type 2 diabetes: a 24-week , randomized , placebo-controlled trial. Diab Obes Metab. 2013; 16(2): 147–158. doi: 10.1111/dom.12188.
68. Zinman B. ,Wanner C. , Lachin J.M. , Fitchett D. , Bluhmki E. ,Hantel S. ,Mattheus M. , Devins T. , Johansen O.E. ,Woerle H.J. , Broedl U.C. , Inzucchi S.E.; EMPA-REG OUTCOME Investigators. Empagl iflozin , Cardiovascular Outcomes , and Mortal ity in Type 2 Diabetes. N Engl J Med. 2015; 373(22): 2117–2128. doi: 10.1056/nejmoa1504720.
69. Marso S.P. , Daniels G.H. , Brown-Frandsen K. , Kristensen P. ,Mann J.F. ,Nauck M.A. ,Nissen S.E. , Pocock S. , Poulter N.R. , Ravn L.S. , Steinberg W.M. , Stockner M. , Zinman B. , Bergenstal R.M. , Buse J.B.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016; 375(4): 311–322. doi: 10.1056/nejmoa1603827.
70. Marso S.P. , Bain S.C. , Consol i A. , El iaschewitz F.G. , Jуdar E. , Leiter L.A. , Lingvay I. , Rosenstock J. , Seufert J. ,Warren M.L. , Woo V., Hansen O. ,Holst A.G. , Pettersson J. , Vilsbшll T.; SUSTAIN-6 Investigators. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016; 375(19): 1834- 1844. doi: 10.1056/ NEJMoa1607141.
71. Cosentino F. , Grant P.J. , Aboyans V. , Bailey C.J. , Ceriello A. , Delgado V. , Federici M. , Fil ippatos G. , Grobbee D.E. , Hansen T.B. ,Huikuri H.V. , Johansson I. , Jüni P. , Lettino M. ,Marx N., Mellbin L.G. ,Östgren C.J. , Rocca B. , Roffi M. ,Sattar N. , Seferović P.M. , Sousa-Uva M. , Valensi P., Wheeler D.C.; ESC Scientific Document Group. 2019 ESC Guidel ines on diabetes , pre-diabetes , and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020; 41(2): 255-323. doi: 10.1093/eurheartj/ehz486.
72. Effect of intensive blood-glucose control with metformin on compl ications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998; 352(9131): 854–865. doi: 10.1016/s0140–6736(98)07037–8
73. Nordestgaard B.G. , Chapman M.J. ,Humphries S.E. , Ginsberg H.N. ,Masana L. , Descamps O.S, Wiklund O. ,Hegele R.A. , Raal F.J. , Defesche J.C. ,Wiegman A. , Santos R.D. ,Watts G.F. , Parhofer K.G. ,Hovingh G.K. , Kovanen P.T. , Boileau C. , Averna M. , Borén J. , Bruckert E. , Catapano A.L,. Kuivenhoven J.A. , Pajukanta P. , Ray K. , Stalenhoef A.F. , Stroes E. , Taskinen M.R. , Tybjærg-Hansen A. Famil ial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for cl inicians to prevent coronary heart disease: consensus statement of the
European Atherosclerosis Society. Eur Heart J. 2013; 34(45): 3478–3490a. doi: 10.1093/eurheartj/eht273.
74. Rosengren A. Better treatment and improved prognosis in elderly patients with AMI: but do registers tell the whole truth? Eur Heart J. 2012; 33(5): 562–563. doi: 10.1093/eurheartj/ehr364.
75. Prospective Studies C. , Lewington S. ,Whitlock G. , Clarke R. , Sherl iker P. , Emberson J. ,Halsey J. , Qizilbash N. , Peto R. , Coll ins R. Blood cholesterol and vascular mortal ity by age , sex , and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007; 370(9602): 1829–1839. doi: 10.1016/ S0140–6736(07)61778–4.
76. Second Joint Task Force of E. Prevention of coronary heart disease in cl inical practice Recommendations of the Second Joint Task Force of European and other Societies on Coronary Prevention. Eur Heart J. 1998; 19(10): 1434–1503. doi: 10.1053/euhj.1998.1243.
77. Lloyd-Jones D.M. , Leip E.P. , Larson M.G. , D'Agostino R.B. , Beiser A. ,Wilson P.W. ,Wolf P.A. , Levy D. Prediction of Lifetime Risk for Cardiovascular Disease by Risk Factor Burden at 50 Years of Age. Circulation. 2006; 113(6): 791–798. doi: 10.1161/circulationaha.105.548206.
78. Berry J.D. , Dyer A. , Cai X. , Garside D.B. ,Ning H. , Thomas A. , Greenland P. , Van Horn L. , Tracy R.P. , Lloyd-Jones D.M. Lifetime Risks of Cardiovascular Disease. N Eng J Med. 2012; 366(4): 321–329. doi: 10.1056/nejmoa1012848.
79. Giang K.W. , Björck L. ,Novak M. , Lappas G. ,Wilhelmsen L. , Torén K. , Rosengren A. Stroke and coronary heart disease: predictive power of standard risk factors into old age—long-term cumulative risk study among men in Gothenburg , Sweden. Eur Heart J. 2013; 34(14): 1068–1074. doi: 10.1093/eurheartj/ehs458.
80. Wilhelmsen L. , Svдrdsudd K. , Eriksson H. , Rosengren A. ,Hansson P.O. ,Wel in C. , Odén A. ,Wel in L. Factors associated with reaching 90 years of age: a study of men born in 1913 in Gothenburg , Sweden. J Intern Med. 2010; 269(4): 441–451. doi: 10.1111/j.1365–2796.2010.02331.x.
81. ReinerŽ. Primary Prevention of Cardiovascular Disease with Statins in the Elderly. Curr Atheroscler Rep. 2014; 16(7): 420. doi: 10.1007/s11883–014–0420–6.
82. Savarese G. , Gotto A.M. , Paol illo S. , D'Amore C. , Losco T. ,Musella F. , Scala O. ,Marciano C. , Ruggiero D. ,Marsico F., De Luca G. , Trimarco B. , Perrone-Filardi P. Benefits of Statins in Elderly Subjects Without Establ ished Cardiovascular Disease. J Am Coll Cardiol. 2013; 62(22): 2090–2099. doi: 10.1016/j.jacc.2013.07.069.
83. Shepherd J. , Blauw G.J. ,Murphy M.B. , Bollen E.L. Buckley B.M. , Cobbe S.M. , Ford I. , Gaw A., Hyland M. , Jukema J.W., Kamper A.M. ,Macfarlane P.W. ,Meinders A.E. ,Norrie J. , Packard C.J. , Perry I.J. , Stott D.J. , Sweeney B.J., Twomey C. ,Westendorp R.G.; PROSPER study group. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002; 360(9346): 1623–1630. doi: 10.1016/s0140– 6736(02)11600-x.
84. Deedwania P. , Stone P.H. , Bairey Merz C.N. , Cosin-Aguilar J. , Koylan N. , Luo D. , Ouyang P. , Piotrowicz R. , Schenck-Gustafsson K. , Sell ier P. , Stein J.H. , Thompson P.L. , Tzivoni D. Effects of Intensive Versus Moderate Lipid-Lowering Therapy on Myocardial Ischemia in Older Patients With Coronary Heart Disease. Circulation. 2007;115(6): 700–707. doi: 10.1161/circulationaha.106.654756.
85. Miettinen T.A. , Pyorala K. , Olsson A.G. ,Musl iner T.A. , Cook T.J. , Faergeman O. , Berg K. , Pedersen T. , Kjekshus J. Cholesterol-Lowering Therapy in Women and Elderly Patients With Myocardial Infarction or Angina Pectoris. Circulation. 1997; 96(12): 4211–4218. doi: 10.1161/01.cir.96.12.4211
86. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomised placebocontrolled trial. Lancet. 2002; 360(9326): 7–22. doi: 10.1016/s0140–6736(02)09327–3.
87. Baigent C. , Landray M.J. , Reith C. , Emberson J. ,Wheeler D.C. , Tomson C. ,Wanner C. , Krane V. , Cass A. , Craig J. , Neal B. , Jiang L., Hooi L.S. , Levin A. , Agodoa L. , Gaziano M. , Kasiske B., Walker R. ,Massy Z.A. , Feldt-Rasmussen B. , Krairittichai U. , Ophascharoensuk V. , Fellström B., Holdaas H. , Tesar V. ,Wiecek A. , Grobbee D. , de Zeeuw D. , Grönhagen-Riska C. , Dasgupta T. , Lewis D. ,Herrington W., Mafham M. ,Majoni W. ,Wallendszus K. , Grimm R. , Pedersen T. , Tobert J. , Armitage J. , Baxter A. , Bray C. , Chen Y. , Chen Z. ,Hill M. , Knott C. , Parish S. , Simpson D. , Sleight P. , Young A. , Coll ins R.; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet. 2011; 377(9784): 2181–2192. doi: 10.1016/S0140–6736(11)60739–3.
88. Tonell i M. ,Wanner C. Lipid Management in Chronic Kidney Disease: Synopsis of the Kidney Disease: Improving Global Outcomes 2013 Cl inical Practice Guidel ine. Ann Intern Med. 2014; 160(3): 182–189. doi: 10.7326/m13–2453.
89. Naci H. , Brugts J. , Ades T. Comparative Tolerabil ity and Harms of Individual Statins. Circ Cardiovasc Qual Outcomes. 2013; 6(4): 390–399. doi: 10.1161/circoutcomes.111.000071.
90. Bruckert E. ,Hayem G. , Dejager S. , Yau C. , Bégaud B. Mild to Moderate Muscular Symptoms with High-Dosage Statin Therapy in Hyperl i pidemic Patients —The PRIMO Study. Cardiovasc Drugs Ther. 2005; 19(6): 403–414. doi: 10.1007/s10557–005–5686-z.
91. Davidson M.H. , Clark J.A. , Glass L.M. , Kanumalla A. Statin Safety: An Appraisal from the Adverse Event Reporting System. Am J Cardiol. 2006; 97(8): S32-S43. doi: 10.1016/j.amjcard.2005.12.008.
92. Marcum Z.A. , Vande Griend J.P. , Linnebur S.A. FDA drug safety communications: a narrative review and clinical considerations for older adults. Am J Geriatr Pharmacother. 2012; 10(4): 264–271. doi: 10.1016/j. amjopharm.2012.05.002.
93. Chalasani N. , Aljadhey H. , Kesterson J. ,Murray M.D. ,Hall S.D. Patients with elevated l iver enzymes are not at higher risk for statin hepatotoxicity. Gastroenterology. 2004; 126(5): 1287–1292. doi: 10.1053/j.
gastro.2004.02.015.
94.Vuppalanchi R. , Chalasani N. , Teal E. Patients with Elevated Basel ine Liver Enzymes Do Not Have Higher Frequency of Hepatotoxicity from Lovastatin than Those with Normal Basel ine Liver Enzymes. Am J Med Sci. 2005; 329(2): 62–65. doi: 10.1097/00000441–200502000–00002.
95. Dongiovanni P. , Petta S. ,Mannisto V. ,Mancina R.M. , Pipitone R. , Karja V. ,Maggioni M. , Kakela P. ,Wiklund O. ,Mozzi E. , Grimaudo S. , Kaminska D. , Rametta R. , Craxi A. , Fargion S. ,Nobil i V. , Romeo S. , Pihlajamaki J. , Valenti L. Statin use and non-alcohol ic steatohepatitis in at risk individuals. J Hepatol. 2015; 63(3): 705–712. doi: 10.1016/j.jhep.2015.05.006.
96. Law M. , Rudnicka A.R. Statin safety: a systematic review. Am J Cardiol. 2006; 97(8A): 52C-60C. doi: 10.1016/j.amjcard.2005.12.010.
97. Li Y.H. , Ueng K.C. , Jeng J.S. , Charng M.J. , Lin T.H. , Chien K.L. ,Wang C.Y. , Chao T.H. , Liu P.Y. , Su C.H. , Chien S.C. , Liou C.W. , Tang S.C. , Lee C.C. , Yu T.Y. , Chen J.W. ,Wu C.C. , Yeh H.I. 2017 Taiwan l ipid guidel ines for high risk patients. JFormos Med Assoc. 2017; 116(4): 217-248. doi: 10.1016/j.jfma.2016.11.013.
